– Nils Venhoff, Ulrich A. Walker –
Einleitung
Zwei Jahre nach Einführung der Proteaseinhibitoren wurden bei HIV-Patienten verschiedene Veränderungen des Körperstoffwechsels beobachtet. Sie wurden zunächst unter dem Sammelbegriff „Lipodystrophie“ zusammengefasst (Carr 1998). Inzwischen wird das Lipodystrophie-Syndrom als eine Überlappung von pathogenetisch distinkten Effekten einzelner antiretroviraler Medikamente aufgefasst. Der Hauptmechanismus, über den Nukleosidanaloga zu Stoffwechsel- und Organveränderungen führen können, ist mit dem Schlagwort „mitochondriale Toxizität“ belegt (Brinkman 1999).
Pathogenese der mitochondrialen Toxizität
NRTIs sind Prodrugs (Kakuda 2000): sie liegen erst nach Aufnahme in die Körperzellen und nach dortiger Phosphorylierung zum Triphosphat in ihrer aktiven Form vor. Die NRTI-Triphosphate sind nicht nur in der Lage, die virale Reverse Transkriptase zu inhibieren, sondern es besteht auch eine Interaktion mit einer Polymerase des Menschen, nämlich mit der so genannten Gamma-Polymerase (Lewis 2003). Diese Polymerase ist für die Replikation von mitochondrialer DNA (mtDNA) essentiell. Die Inhibition der Gamma-Polymerase durch NRTIs führt somit zu einer quantitativen Verminderung (Depletion) der in jedem Mitochondrion in mehrfacher Kopie vorliegenden mitochondrialen DNA (mtDNA). MtDNA kodiert für Untereinheiten der mitochondrialen Atmungskette. Über den Mechanismus der mtDNA-Depletion stören manche NRTIs so die Atmungskette.
Eine intakte Atmungskette ist Voraussetzung für viele Stoffwechselfunktionen: ihre Hauptaufgabe ist die oxidative Synthese von ATP. Zusätzlich verstoffwechselt die Atmungskette aber auch NADH sowie FADH als Endprodukte des Fettsäureabbaus. Dies erklärt die bei mitochondrialer Toxizität häufig beobachtete fein- oder grobtropfige intrazelluläre Akkumulation von Triglyzeriden. Letztlich ist eine intakte Atmungskette auch für die Synthese von DNS-Bausteinen unabdingbar, da die Dihydroorotsäure-Dehydrogenase (DHODH), ein für die Neusynthese von Pyrimidinnukleosiden wichtiges Enzym, in der inneren Mitochondrienmembran lokalisiert ist (Löffler 1997). Was dies klinisch bedeutet, wird unten erläutert. Die mitochondriale Toxizität folgt bestimmten Prinzipien (Walker 2002a):
1. Es besteht eine Dosis-Wirkungsbeziehung – eine hohe NRTI-Konzentration führt zu einer stärkeren mtDNA-Depletion. Die Dosen mancher NRTIs liegen hinsichtlich „mitochondrialer“ Nebenwirkungen an der oberen Grenze der Verträglichkeit.
2. Es besteht eine Zeitabhängigkeit – die mtDNA-Depletion entwickelt sich in aller Regel erst mit prolongierter NRTI-Exposition. Bei längerer Exposition können daher auch relativ geringe Medikamentenspiegel bereits zu Nebenwirkungen führen.
3. Es gibt quantitative Unterschiede in der Potenz der Nukleosid- und Nukleotidanaloga, mit der Gamma-Polymerase zu interagieren. Für die aktiven Metabolite der nachfolgenden Substanzen besteht eine Hemmhierarchie: ddC > DDI (Videx®) > D4T (Zerit®) > 3TC (Epivir®) ≥ ABC (Ziagen®) ≥ TDF (Viread®) ≥ FTC (Emtriva®).
4. AZT ist ein Sonderfall. AZT-Triphosphat ist nämlich nur ein sehr schwacher Inhibitor der Gamma-Polymerase. Ein anderer Mechanismus erklärt aber die mtDNA-Depletion unter AZT auch unabhängig von einer Gamma-Polymerasehemmung. AZT ist ein Hemmer intrazellulärer Thymidinkinasen und kann somit die Synthese von DNA-Bausteinen inhibieren und eine mtDNA-Depletion induzieren (McKee 2004, Saada 2001). Tatsächlich führt die Hemmung der Thymidinkinase 2 in Mäusen zu einem Phänotyp, der dem der AZT-Dauerbehandlung sehr ähnelt (Zhou 2008). AZT scheint in manchen Körperzellen auch zu D4T verstoffwechselt zu werden (Becher 2003, Bonora 2004).
5. Die mitochondriale Toxizität ist gewebespezifisch. Dies erklärt sich aus der Tatsache, dass die intrazelluläre und intramitochondriale Aufnahme, sowie die Aktivierung der NRTIs durch Phosphorylierung von Zelltyp zu Zelltyp sehr unterschiedlich ablaufen können.
6. Zwei und mehrere NRTIs können sich in ihrer Toxizität gegenseitig verstärken.
7. Auch unabhängig von mtDNA-Alterationen könnte es zu einer Beeinträchtigung der mitochondrialen Transkription kommen (Mallon 2005, Cossarizza 2005). Mechanismus und klinische Bedeutung dieses Umstandes sind noch unklar.
Klinisches Spektrum
Die mtDNA-Depletion manifestiert sich klinisch an den folgenden Zielorganen (Abbildung 1):
In der Leber kommt es anfangs zu einer Steatose mit oder ohne erhöhte Serumtransaminasen. Die Steatohepatitis kann bereits unter DDI-Monotherapie auftreten, von einer Laktatazidose begleitet sein und dann zum Leberversagen voranschreiten (Lambert 1990). Die Hepatotoxizität wird insbesondere unter Therapie mit den Dideoxynukleosiden beobachtet, also unter DDI und D4T, aber auch unter AZT (McGovern 2006). Die hepatische mtDNA-Depletion ist abhängig von der Therapiedauer (Walker 2004a). Lichtmikroskopisch ist die Steatose makro- oder mikrovesikulär, unter dem Elektronenmikroskop findet man abnorme Mitochondrien.
Typisches, jedoch nicht obligates Merkmal der mitochondrialen Toxizität ist eine Erhöhung des Serum-Laktats. Erhöhte Laktatspiegel werden insbesondere unter prolongierter D4T-Therapie beobachtet (Saint-Marc 1999, Carr 2000). Ein synergistischer oder additiver Effekt durch andere NRTIs (insbesondere durch DDI) ist wahrscheinlich. Auch Ribavirin und Hydroxyurea führen zu einer verstärkten Toxizität von DDI. Oft bleibt die Hyperlaktatämie asymptomatisch.
Falls überhaupt Symptome auftreten, sind diese oft unspezifisch und manifestieren sich mit Nausea, rechtsseitigen Oberbauchbeschwerden oder Myalgien. Die Anionenlücke (Na+ – [HCO3– + Cl–]) ist nicht immer verkleinert (normal 8-16 mmol/l). Daher ist man für die Diagnose auf die logistisch relativ aufwendige Laktatbestimmung angewiesen. Das Venenblut muss im Fluoridröhrchen am nicht gestauten Arm des ruhenden Patienten abgenommen werden und sofort auf Eis ins Labor gebracht werden. Ist die Laktatazidose diagnostiziert, sollten nicht-mitochondriale Ursachen differentialdiagnostisch berücksichtigt werden (Tab. 1). Gleichzeitig muss auch nach Toxizitätszeichen an weiteren Organen gesucht werden. Die Laktatazidose ist mit einer Inzidenz von 1 pro 1000 Patientenjahren bei NRTI-exponierten Patienten selten (Imhof 2005), eine Studie in Südafrika berichtete jedoch mit 16,1 Fällen pro 1000 Patientenjahren eine deutlich höhere Inzidenz (Bolhaar 2007).
Abbildung 1: Manifestationsmöglichkeiten mitochondrialer Toxizität. Bei den mit Fragezeichen versehenen Symptomen ist die Assoziation noch unklar.
Tabelle 1: Ursachen einer Hyperlaktatämie/Laktatazidose |
|
| Typ A-Laktatazidose | Typ B-Laktatazidose |
| (durch Gewebshypoxie)SchockKohlenmonoxidvergiftung
Herzversagen
|
(durch andere Mechanismen)ThiaminmangelAlkalose (pH>7,6)
Krampfanfälle Adrenalin (iatrogen, endogen) Leberinsuffizienz Neoplasien (Lymphome, solide Tumoren) Vergiftung (Nitroprussid, Methanol, Methylenglykol, Salicylate) Fruktose Seltene Enzymdefekte mtDNA-Mutationen mtDNA-Depletion |
Die mitochondriale Myopathie wurde zuerst unter AZT beschrieben (Arnaudo 1991). Meist erst mehrere Monate nach Einleitung einer ART kommt es zu einer belastungsabhängigen Skelettmuskelschwäche, oft ohne wesentliche Erhöhung der Serum-CK. Die NRTI-toxische Myopathie kann histologisch durch den Nachweis zahlreicher Muskelfasern mit negativer Reaktion in der Cytochrom c-Oxidase Histochemie, sowie durch die elektronenmikroskopische Visualisierung morphologischer Mitochondrienanomalien von der zum Teil simultan vorkommenden HIV-assoziierten Myopathie abgegrenzt werden. Bei letzterer sind Infiltrate mit CD8-T-Lymphozyten typisch. Die Spiroergometrie kann zwar eine niedrige Laktatschwelle und nach Belastungsende eine verzögerte Laktat-Clearance detektieren, die Abgrenzung der mitochondrialen Myopathie gegenüber einem Trainingsmangel ist jedoch durch dieses Verfahren schwierig.
In Mäusen konnte eine mitochondriale Kardiomyopathie sowohl durch AZT als auch durch ddC induziert werden. Diese manifestierte sich mit vergrößerten Mitochondrien, zerstörter Architektur sowie mit Depletion von mtDNA und Atmungskettenproteinen (Balcarek 2010).
Auch die häufige, vorwiegend symmetrische, sensible und auf die distalen Abschnitte der unteren Extremitäten beschränkte Polyneuropathie ist vor allem mit prolongierter Einnahme von D4T und DDI assoziiert (Simpson 1995, Moyle 1998). Diese mitochondriale Form der Axonschädigung kann von der HIV-assoziierten PNP durch den Nachweis einer Laktaterhöhung mit hinreichender Sensitivität und Spezifität differenziert werden. Zudem tritt die D-Drug-assoziierte Polyneuropathie meist erst nach mehreren Monaten auf, während sich die HIV-assoziierte Polyneuropathie unter Medikation meist nicht verschlechtert. In Mäusen induzieren AZT und DDC eine mitochondriale Neurotoxizität, wobei DDC vorwiegend das periphere und AZT vorwiegend das zentrale Nervensystem schädigt (Venhoff 2010). Die murinen Daten zur Neuropathie stimmen mit Beobachtungen bei HIV-infizierten Patienten überein (Tardieu 2005, Moyle 1998); die toxischen Effekte von AZT auf das ZNS sind plausibel, da AZT sehr gut die Blutliquorschranke penetriert.
Unter „Lipodystrophie“ wird im engeren Sinne eine Änderung des Fettverteilungsmusters unter Langzeit-ART verstanden (siehe auch Lipodystrophie-Syndrom). Das Lipodystrophie-Syndrom setzt sich phänomenologisch zum einen aus einem Fettüberschuss (v.a. im Bereich des Nackens sowie intraabdominal) und zum anderen aus einem subkutanen Fettverlust (im Gesicht v.a. bukkal und temporal, sowie an den Extremitäten) zusammen. Beide Komponenten können unabhängig voneinander, aber auch simultan vorkommen. Nach ART-Beginn beginnt das Fett-Wasting (Lipoatrophie) in der Regel erst nach einem Jahr. Als besonderer Risikofaktor wurde in mehreren randomisierten Studien eine Behandlung mit D4T identifiziert, wobei ein Effekt anderer NRTIs nicht ausgeschlossen und für AZT sogar wahrscheinlich ist. Tatsächlich finden sich unter D4T im subkutanen Fett ultrastrukturelle Anomalien der Mitochondrien und eine mtDNA-Depletion (Walker 2002b). Im Adipozyten bzw. im Fettgewebe führt die prolongierte NRTI-Exposition zur mtDNA-Depletion, zu einer verminderten Expression adipogener Transkriptionsfaktoren (PPAR-gamma und SREBP-1), zu vermehrter Apoptose und zu vermindertem Fettgehalt. Zusätzlich kommt es zur Minderexpression bestimmter Adipokine (Adiponektin u.a.), was zu einer Insulinresistenz führen kann. D4T konnte als wesentlicher Risikofaktor identifiziert werden, aber auch AZT scheint mit der Entwicklung einer Lipoatrophie assoziiert zu sein. Nach Absetzen von D4T kommt es neben einer Erholung der mtDNA und der Apoptoserate (McComsey 2005) zu einem objektivierbaren, aber quantitativ gering ausgeprägten und langsamen Zuwachs an Subkutanfett (McComsey 2004). Switch-Studien unter Vermeidung von PIs führten dagegen weder zu einer Besserung der Fettgewebsapoptose, noch zu einer Besserung der Lipoatrophie. Die Entstehung der Lipoatrophie ist somit über den Mechanismus der mitochondrialen NRTI-Toxizität hinreichend erklärt.
Auch im peripheren Blut wurde unter ART eine mtDNA-Depletion nachgewiesen (Côté 2003, Miro 2003). Die funktionellen Konsequenzen auf Lymphozyten sind noch wenig bekannt. Unter DDI kann es unter bestimmten Umständen zu einem Abfall der CD4- und CD8-T-Lymphozyten kommen (Negredo 2004). Mitotisch stimulierte T-Lymphozyten entwickeln unter DDI-Exposition eine mtDNA-Depletion mit herabgesetzter Proliferationsfähigkeit und erhöhtem Apoptoseindex (Setzer 2005a, Setzer 2005b). Somit gibt es Hinweise, dass die mitochondriale Toxizität in Lymphozyten immunsuppressiv ist.
Asymptomatische Erhöhungen der Serum-Lipase sind unter ART zwar nicht selten, allerdings ohne wesentlichen Nutzen in der Vorhersage einer Pankreatitis (Maxson 1992). Eine manifeste Pankreatitis wurde unter NRTIs (insbesondere unter DDI) mit einer Häufigkeit von 0,8/100 Behandlungsjahren beschrieben. Eine DDI-Reexposition nach Ausheilung kann zu einem Rezidiv führen und sollte vermieden werden. Ein mitochondrialer Mechanismus für die Pankreatitis ist nicht bewiesen.
Auch eine Erhöhung der Serum-Harnsäure wurde unter Therapie mit Dideoxynukleosiden (DDI und D4T) beobachtet. Eine verminderte ATP-Produktion als Folge der mitochondrialen Toxizität könnte den Purin-Nukleotid-Zyklus ankurbeln und so die Hyperurikämie verursachen (Walker 2006a).
Nach langjähriger kontroverser Diskussion zeigen mittlerweile mehrere Studien Evidenz für mitochondriale Nephrotoxizität von Tenofovir (TDF, Viread®). Unter diesem Nukleotidischem Reverse Transkriptase Inhibitor wurden Fälle einer renalen Dysfunktion mit Fanconi-Syndrom, sowie Fälle von Osteomalazie sowohl in Tieren (Tenofovir review team 2001) als auch bei Menschen beschrieben wurden (Gupta 2008, Wanner 2009). Unter Tenofovir kann es zu einer verminderten renalen Phosphatresorption mit konsekutiver Hypophosphatämie sowie erhöhter alkalischer Phosphatase kommen (Kinai 2005). Die aus dem renalen Phosphatverlust resultierende Knochendemineralisierung kann zur Osteomalazie führen (Wanner 2009) (siehe auch Kapitel „HIV und Rheumatische Erkrankungen“). Ein gehäuftes Auftreten wird insbesondere in der Kombination von TDF mit Lopinavir/r vermutet (Parsonage 2005). Tenofovir wird durch die humanen organischen Anionen-Transporter (hOAT) 1 und 3 in die Zellen des proximalen Tubulusepithels aufgenommen. Die durch hOAT generierten hohen intrazellulären Tenofovir Konzentrationen könnten die mtDNA-Replikation inhibieren, obwohl Tenofovir an sich nur ein schwacher Hemmer der Polymerase-gamma ist (Cote 2006). In Nierenbiopsien fand sich eine mtDNA-Verminderung bei Patienten, die die aus verschiedenen Gründen heute nicht mehr empfohlene Kombination von TDF+DDI erhalten hatten (Côté 2006). In Ratten induzierte TDF eine organ-spezifische Nephrotoxizität mit mtDNA-Depletion und Dysfunktion der mtDNA-kodierten Atmungskettenuntereinheiten in den Tubulusepithelzellen (Lebrecht 2009).
Die derzeit durchgeführte AZT-Prophylaxe zur Verhinderung der vertikalen HIV-Transmission führt bei perinatal exponierten Kindern zu niedrigen mtDNA-Spiegeln in der Plazenta und im Nabelschnurblut (Shiramizu 2003, Divi 2005, Gingelmaier 2009), zu einer transienten Anämie und zu einer über Monate nachweisbaren Neutropenie, Thrombopenie oder Lymphopenie. Bei schwangeren Affen, die vor der Geburt mit AZT und 3TC behandelt worden waren, konnte der Einbau von AZT in die mtDNA sowie eine mtDNA-Depletion in Skelettmuskulatur, Herz und Gehirn nachgewiesen werden (Gerschenson 2004), welche in einigen Tieren noch bis Monate nach Absetzen der NRTI-Exposition persistierte. Eine französische Kohorte fand eine Häufung mitochondrialer Syndrome, bei anderen perinatal NRTI- exponierten Kindern konnten Abnormitäten in der cerebralen Bildgebung festgestellt werden (Blanche 1999, Tardieu 2005). Eine deutliche Hyperlaktatämie ist ebenfalls nicht selten und kann nach der Geburt für mehrere Monate persistieren (Noguera 2003). Andere klinische Studien dagegen zeigten kein erhöhtes Risiko in Assoziation mit der perinatalen AZT-Prophylaxe, auch wenn die Schlüsselparameter mitochondrialer Dysfunktion nicht immer erfasst wurden. Langzeitstudien sind dringend notwendig (Venhoff 2006). Die bisher verfügbaren Informationen erlauben es nach wie vor nicht, von AZT als Teil einer Kombinationstherapie zur Vermeidung vertikaler HIV-Transmission abzuweichen.
Monitoring und Diagnose
Derzeit gibt es keine Methode, um das individuelle „mitochondriale Risiko“ verlässlich vorherzusagen. Ein Routine-Laktatscreening asymptomatischer NRTI-behandelter Patienten ist nicht verlässlich, da weder erhöhte noch normale Laktatwerte in asymptomatischen Patienten prädiktiv sind für klinische mitochondriale Toxizität (McComsey 2004). Die Quantifizierung der mtDNA im Blut ist ebenfalls nicht aussagekräftig. Zur Beurteilung der oxidativen Kapazität hepatischer Mitochondrien wurde in mehreren Studien der [13C]Methionin-Atemtest verwendet, der jedoch aufgrund verschiedener Störfaktoren ebenfalls schwierig zu standardisieren scheint (Sternfeld 2009).
Wahrscheinlich wäre eine Bestimmung der mtDNA in betroffenen Geweben der sensitivste Parameter; dies ist jedoch invasiv und bisher klinisch nicht evaluiert. Bei manifester Symptomatik kann eine Gewebsbiopsie allerdings hilfreich sein. Im Muskel und in anderen Geweben weisen verschiedene Phänomene auf eine mitochondriale Toxizität hin. Dazu zählen höhergradige ultrastrukturelle Anomalien der Mitochondrien, eine Verminderung der histochemischen Aktivität der Cytochrom c-Oxidase bei gleichzeitig vermehrter Succinatdehydrogenase-Aktivität, der Nachweis einer intrazellulären, insbesondere mikrovesikulären Steatose, sowie so genannte Ragged-Red Fibers.
Therapie, Prophylaxe mitochondrialer Toxizität
Interaktionen
Medikamenteninteraktionen müssen beachtet werden. Vor allem bei DDI ist Vorsicht geboten, da die mitochondriale Toxizität durch Interaktionen mit Ribavirin, Hydroxyurea und Allopurinol verstärkt wird (Ray 2004). Auch unter Tenofovir muss die DDI-Tagesdosis auf 250 mg herabgesetzt werden. Ein Metabolit von Brivudin (Zostex®) hemmt die Dihydroorotsäuredehydrogenase (s.u.) und sensibilisiert somit potentiell gegenüber der mitochondrialen Toxizität von NRTIs. Brivudin sollte daher nicht mit antiretroviralen Pyrimidinanaloga kombiniert werden.
Lopinavir/r erhöht über verschiedene Mechanismen die Serumspiegel von Tenofovir und zusätzlich auch die Konzentration von Tenofovir in den Zellen der proximalen Nierentubuli (Kearney 2006). Publiziert sind drei Fälle einer renalen Osteomalazie unter Tenofovir bei Patienten, die gleichzeitig Lopinavir erhielten. Ob hier ein Kausalzusammenhang besteht, ist unklar.
Negative Auswirkungen auf den Mitochondrienstoffwechsel können auch aus einer Komedikation mit Ibuprofen, Valproinsäure und Acetylsalicylsäure resultieren – diese Substanzen hemmen die mitochondriale Utilisation von Fettsäuren. Acetylsalicylsäure kann so die Mitochondrien schädigen und zu einem Reye-Syndrom führen. Valproinsäure kann eine lebensbedrohliche Laktatazidose triggern. Amiodaron und Tamoxifen inhibieren die mitochondriale ATP-Synthese. Acetaminophen reduziert das antioxidative Glutathion und kompromittiert so die Mitochondrienfunktion indirekt über Radikalmechanismen. Aminoglykoside und Chloramphenicol inhibieren nicht nur die Proteinsynthese der Bakterien, sondern unter bestimmten Umständen auch die Proteinsynthese der den Bakterien ähnlichen Mitochondrien. Adefovir und Cidofovir hemmen die Polymerase-gamma. Auch Alkohol ist ein mitochondriales Toxin.
Die wichtigste Intervention ist das Absetzen der für die mitochondriale Toxizität verantwortlichen NRTIs. In randomisierten Studien führte der Ersatz von D4T durch Alternativ-NRTIs zu einer leichten, langsam einsetzenden, aber objektivierbaren Besserung der Lipoatrophie (McComsey 2004, Martin 2004, Moyle 2005). Hingegen führte ein Switch von PIs zu NNRTIs in mehreren Studien nicht zu einer Besserung der Lipoatrophie. Dies unterstreicht die wesentliche Rolle der mitochondrialen Toxizität in der Pathogenese des Fettwastings.
Uridin
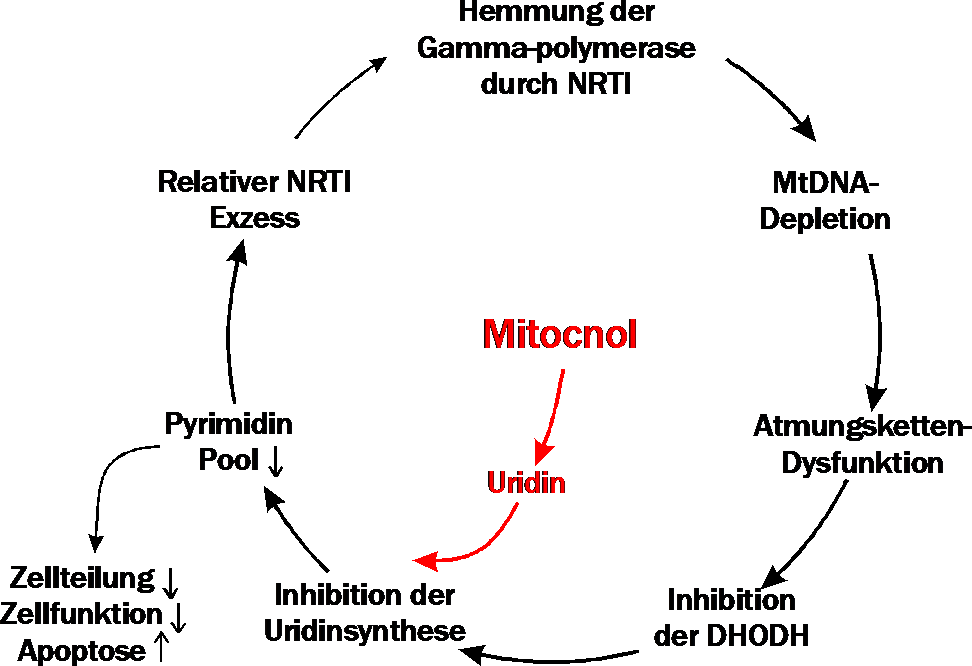
Wenn die NRTIs nicht abgesetzt bzw. modifiziert werden können, besteht die einzige derzeit verfügbare Therapie der mitochondrialen Toxizität in der Gabe von Uridin oder seinen Vorläufersubstanzen. Wie oben erläutert, bewirkt die Hemmung der Atmungskette durch NRTIs auch eine Hemmung der Dihydroorotsäuredehydrogenase (DHODH) (Abbildung 2). Aus der Dysfunktion der DHODH resultiert eine Verminderung der durch dieses Enzym katalysierten Uridinsynthese und damit auch der aus Uridin synthetisierten Pyrimidine. Der verminderte intrazelluläre Pyrimidinpool verstärkt nun die relative Konzentration der mit ihm an der Gamma-Polymerase kompetitierenden und für die Toxizität verantwortlichen Pyrimidinnukleosidanaloga. Ein Circulus vitiosus schließt sich und verstärkt so die Entstehung der mtDNA-Depletion. Durch Gabe von Uridin kann dieser Circulus vitiosus durchbrochen und die Spiegel mitochondrialer DNA angehoben werden (Setzer 2008). In Hepatozyten normalisierte Uridin die Zellfunktion selbst bei fortgesetzter Behandlung mit NRTI-Pyrimidinanaloga (Walker 2003). Uridin führt auch in D4T-exponierten Adipozyten zu einer Normalisierung der Fettspeicherung und der Mitochondrienfunktion (Walker 2006b). Uridin wird selbst in hoher oraler und intravenöser Dosierung gut vertragen (van Groeningen 1986, Kelsen 1997).
Abbildung 2: Wirkmechanismus von Mitocnol (NucleomaxX®) bei mitochondrialer Toxizität.
Mit Mitocnol steht ein Nahrungsergänzungsmittel zur Verfügung, das gegenüber reinem Uridin eine ca. 8-fach bessere Uridin-Bioverfügbarkeit hat (Venhoff 2005, Weinberg 2011). Eine randomisierte, plazebokontrollierte Doppelblindstudie wies nach, dass Mitocnol die Lipoatrophie unter fortgesetzter Therapie mit D4T und AZT effektiv bessert (Sutinen 2007). Im Vergleich zu Switchstrategien (also dem Ersetzen von D4T und AZT durch andere Virostatika) war der Effekt von Mitocnol auf die Lipoatrophie rascher und deutlich stärker. In einer zweiten Studie erwies sich Mitocnol in Bezug auf die vom Patienten und die vom Arzt eingeschätzten Lipoatrophie-Scores ebenfalls als wirksam (McComsey 2008). In der prospektiven, randomisierten, placebo-kontrollierten Multicenter Studie ACTG 5229 wurde die Effektivität von Uridin bzgl. Verbesserung einer manifesten Lipoatrophie bei HIV-infizierten Patienten unter ART mit Thymidinanaloga untersucht. Während sich zu Woche 24 noch eine signifikante Zunahme des subkutanen Fettgewebes im Uridin-Arm verglichen mit dem Placebo-Arm zeigte, konnte in Woche 48 kein signifikanter Unterschied mehr zwischen den beiden Studienarmen festgestellt werden (McComsey 2010). Die Hoffnungen, die lange in die Anwendung von Uridin bei der Behandlung der tNRTI-assoziierten Lipoatrophie gesetzt wurden, haben durch diese Studienresultate einen deutlichen Dämpfer bekommen.
Die mitochondriale Steatohepatitis wird jedoch durch Mitocnol sowohl im Tiermodell als auch beim HIV-Patienten antagonisiert (Walker 2004b, Banasch 2006, Lebrecht 2007). Tierversuche sprechen auch für günstige Effekte von Uridin bei der AZT-induzierten Hämatotoxizität (Sommadossi 1988). Bei der AZT-Myopathie verhinderte Mitocnol eine mtDNA-Depletion und die hiermit assoziierte Muskelatrophie und Steatose (Lebrecht 2008). Auch die NRTI-induzierte Kardiomyopathie konnte erfolgreich antagonisiert werden (Balcarek 2010). Letztlich wird auch die mitochondriale Neurotoxizität wie z.B. die Polyneuropathie im Tiermodel durch Mitocnol erfolgreich antagonisiert (Venhoff 2010).
Nebenwirkungen von Mitocnol wurden bisher weder beim Menschen, noch im Tierversuch beobachtet. Ein negativer Einfluss auf die Wirksamkeit der antiretroviralen Therapie wurde bislang weder in vitro, noch in klinischen Studien nachgewiesen (Sommadossi 1988, Koch 2003, McComsey 2007, Sutinen 2007). Es besteht keine Interaktion von Mitocnol mit der Bioverfügbarkeit anderer Pyrimidin-Nukleosidanaloga (Venhoff 2008). Mitocnol ist unter dem Handelsnamen NucleomaxX® in Europa als Nahrungsergänzungsmittel anerkannt und kann über Internet (www.nucleomaxX.com) und Apotheken bezogen werden.
Hyperlaktatämie
Im Falle einer asymptomatischen Hyperlaktatämie von über 5 mmol/l, einer symptomatischen Hyperlaktatämie (und erst recht bei lebensbedrohlicher) Laktatazidose sollten die NRTIs pausiert werden (Brinkman 2000).
Tabelle 2: Supportive Therapie der Laktaterhöhung bei HIV-Patienten (nicht schwangere Erwachsene) |
|
| Laktat 2-5 mmol/L + Symptomatik | Laktat > 5 mmol/L oder Laktatazidose |
| Absetzen mitochondrientoxischer SubstanzenEventuellMitocnol (NucleomaxX® 3 x 36 g an 3 folgenden Tagen pro Monat)
und Vitamine
|
Absetzen mitochondrientoxischer SubstanzenIntensivstationKorrektur einer Hypoglykämie
Hb > 10 g/dl Vasokonstriktorische Substanzen meiden Sauerstoff Mitocnol (NucleomaxX® 3 x 36 g/Tag) bis Laktat < 5 mmol/l) Bikarbonat (kontrovers) 50-100 mmol wenn pH < 7,1 Coenzym Q10 (3 x 100 mg/Tag) Vitamin C (3 x 1 g/Tag) Thiamin (Vit. B1, 3 x 100 mg/Tag) Riboflavin (Vit. B2, 100 mg/Tag) Pyridoxin (Vit. B6, 60 mg/Tag) L-Carnitin (3 x 1 g/Tag) |
Für die Wirksamkeit von Vitamincocktails in Bezug auf die mtDNA-Depletion gibt es weder in vitro noch in klinischen Studien einen Nachweis (Walker 1995, Venhoff 2002).
In Tierversuchen und beim Menschen bessert Mitocnol die Hyperlaktatämie (Sutinen 2007, Lebrecht 2008). Eine NRTI-Reexposition kann nach Normalisierung des Laktates unter engmaschigem Monitoring riskiert werden. Die supportive Therapie der Laktaterhöhung ist in Tabelle 2 zusammengefasst.
Literatur
Arnaudo E, Dalakas M, Shanske S, Moraes CT, DiMauro S, Schon EA. Depletion of muscle mitochondrial DNA in AIDS patients with zidovudine-induced myopathy. Lancet 1991, 337:508-10.
Banasch M, Goetze O, Knyhala K, et al. Uridine supplementation enhances hepatic mitochondrial function in thymidine-analogue treated HIV-infected patients. Antivir Ther 2006 20:1554-6.
Becher F, Pruvost AG, Schlemmer DD, et al. Significant levels of intracellular stavudine triphosphate are found in HIV-infected zidovudine-treated patients. AIDS 2003, 17:555-61.
Balcarek K, Venhoff N, Deveaud C, et al. Role of pyrimidine depletion in the mitochondrial cardiotoxicity of nucleoside analogue reverse transcriptase inhibitors. J AIDS 2010, pub ahead of print
Blanche S, Tardieu M, Rustin P, et al. Persistent mitochondrial dysfunction and perinatal exposure to antiretroviral nucleoside analogues. Lancet 1999, 354:1084-9.
Bolhaar MG, Karstaedt AS. A high incidence of lactic acidosis and symptomatic hyperlactatemia in women receiving highly active antiretroviral therapy in Soweto, South Africa. Clin Infect Dis 2007; 45:254-260.
Bonora S, Boffito M, D’Avolio A, et al. Detection of stavudine concentrations in plasma of HIV-infected patients taking zidovudine. AIDS 2004, 18:577-8.
Brinkman K, Smeitink JA, Romijn JA, Reiss P. Mitochondrial toxicity induced by nucleoside-analogue reverse-transcriptase inhibitors is a key factor in the pathogenesis of antiretroviral-therapy-related lipodystrophy. Lancet 1999, 354:1112-5.
Brinkman K, Vrouenraets S, Kauffman R, Weigel H, Frissen J. Treatment of nucleoside reverse transcriptase inhibitor-induced lactic acidosis. AIDS 2000, 14:2801-2.
Carr A, Miller J, Law M, Cooper DA. A syndrome of lipoatrophy, lactic acidaemia and liver dysfunction associated with HIV nucleoside analogue therapy: contribution to protease inhibitor-related lipodystrophy syndrome. AIDS 2000, 14:F25-F32.
Carr A, Samaras K, Burton S, et al. A syndrome of peripheral lipodystrophy, hyperlipidaemia and insulin resistance in patients receiving HIV protease inhibitors. AIDS 1998, 12:F51-F58.
Côté HC, Yip B, Asselin JJ, et al. Mitochondrial:nuclear DNA ratios in peripheral blood cells from HIV-infected patients who received selected HIV antiretroviral drug regimens. J Infect Dis 2003, 187:1972-6.
Côté HC, Magil A, Harris M, et al. Exploring mitochondrial nephrotoxicity as a potential mechanism of kidney dysfunction among HIV-infected patients on highly active antiretroviral therapy. Antivir Ther 2006, 11:79-86.
Divi RL, Walker VE, Wade NA, et al. Mitochondrial damage and DNA depletion in cord blood and umbilical cord from infants exposed in utero to Combivir. AIDS 2004, 18:1013-21.
Galluzzi L, Pinti M, Troiano L, et al. Changes in mitochondrial RNA production in cells treated with nucleoside analogues. Antivir Ther 2005, 10:191-5.
Gerschenson M, Nguyen V, Ewings EL, et al. Mitochondrial toxicity in fetal Erythrocebus patas monkeys exposed transplacentally to zidovudine plus lamivudine. AIDS Res Hum Retroviruses 2004; 20: 91-100.
Gingelmaier A, Grubert TA, Kost BP et al. Mitochondrial toxicity in HIV type-1-exposed pregnancies in the era of highly active antiretroviral therapy. Antivir Ther 2009; 14: 331-338.
Gupta SK. Tenofovir-associated Fanconi syndrome: review of the FDA adverse event reporting system. AIDS Patient Care STDS 2008; 22: 99-103.
Imhof A, Ledergerber B, Günthard HF et al. Risk factors for and outcome of hyperlactatemia in HIV-infected persons: is there a need for routine lactate monitoring? Clin Infect Dis 2005; 41:721-728.
Kakuda TN. Pharmacology of nucleoside and nucleotide reverse transcriptase inhibitor-induced mitochondrial toxicity. Clin Ther 2000, 22:685-708.
Kearney BP, Mathias A, Mittan A, Sayre J, Ebrahimi R, Cheng AK. Pharmacokinetics and safety of tenofovir disoproxil fumarate on coadministration with lopinavir/ritonavir. J AIDS 2006, 43:278-83.
Kelsen DP, Martin D, O’Neil J, et al. Phase I trial of PN401, an oral prodrug of uridine, to prevent toxicity from fluorouracil in patients with advanced cancer. J Clin Oncol 1997, 15:1511-7.
Kinai E, Hanabusa H. Renal tubular toxicity associated with tenofovir assessed using urine-beta 2 microglobulin, percentage of tubular reabsorption of phosphate and alkaline phosphatase levels. AIDS 2005, 19:2031-3.
Koch EC, Schneider J, Weiss R, Penning B, Walker UA. Uridine excess does not interfere with the antiretroviral efficacy of nucleoside analogue reverse transcriptase inhibitors. Antivir Ther 2003, 8:485-7.
Lambert JS, Seidlin M, Reichman RC, et al. 2′,3′-dideoxyinosine (ddI) in patients with the AIDS or AIDS-related complex. NEJM 1990, 322:1333-40.
Lebrecht D, Vargas-Infante YA, Setzer B, Kirschner J, Walker UA. Uridine supplementation antagonizes zalcitabine-induced microvesicular steatohepatitis in mice. Hepatology 2007;45:72-9.
Lebrecht D, Deveaud C, Beauvoit B, Bonnet J, Kirschner J, Walker UA. Uridine supplementation antagonizes zidovudine-induced mitochondrial myopathy and hyperlactatemia in mice. Arthritis Rheum 2008;58:318-26.
Lebrecht D, Venhoff AC, Kirschner J, Wiech T, Venhoff N, Walker UA. Mitochondrial tubulopathy in tenofovir-DF treated rats. J AIDS 2009; 1: 258-63.
Lewis W, Day BJ, Copeland WC. Mitochondrial toxicity of NRTI antiviral drugs: an integrated cellular perspective. Nat Rev Drug Discov 2003, 2:812-22.
Löffler M, Jöckel J, Schuster G, Becker C. Dihydroorotat-ubiquinone oxidoreductase links mitochondria in the biosynthesis of pyrimidine nucleotides. Mol Cell Biochem 1997, 174:125-9.
Martin A, Smith DE, Carr A et al. Reversibility of lipoatrophy in HIV-infected patients 2 years after switching from a thymidine analogue to abacavir: the MITOX Extension Study. AIDS 2004, 18:1029-36.
Maxson CJ, Greenfield SM, Turner JL. Acute pancreatitis as a common complication of 2′,3′-dideoxyinosine therapy in the acquired immunodeficiency syndrome. Am J Gastroenterol 1992, 87:708-13.
Mallon PW, Unemori P, Sedwell R et al. In vivo, nucleoside reverse-transcriptase inhibitors alter expression of both mitochondrial and lipid metabolism genes in the absence of depletion of mitochondrial DNA. J Infect Dis 2005, 191:1686-96.
McComsey GA, Paulsen DM, Lonergan JT et al. Improvements in lipoatrophy, mitochondrial DNA levels and fat apoptosis after replacing stavudine with abacavir or zidovudine. AIDS 2005; 19: 15-23.
McComsey GA, Walker UA, Budhathoki CB et al. Uridine supplementation in the treatment of HIV lipoatrophy: results of ACTG 5229. AIDS 2010;24:2507-15.
McComsey GA, Ward DJ, Hessenthaler SM, et al. Improvement in lipoatrophy associated with highly active antiretroviral therapy in hiv-infected patients switched from stavudine to abacavir or zidovudine: the results of the TARHEEL study. Clin Infect Dis 2004, 38:263-70.
McComsey GA, O´Riordan M, Setzer B, Lebrecht D, Baron E, Walker UA. Uridine supplementation in HIV lipoatrophy: pilot trial on safety and effect on mitochondrial indices. Eur J Clin Nutr 2008; 62:1031-7
McGovern BH, Ditelberg JS, Taylor LE, et al. Hepatic steatosis is associated with fibrosis, nucleoside analogue use, and hepatitis C virus genotype 3 infection in HIV-seropositive patients. Clin Infect Dis 2006;43:365-72.
McKee EE, Bentley AT, Hatch M, et al. Phosphorylation of thymidine and AZT in heart mitochondria: elucidation of a novel mechanism of AZT cardiotoxicity. Cardiovasc Toxicol 2004, 4:155-67.
Miro O, Lopez S, Pedrol E, et al. Mitochondrial DNA depletion and respiratory chain enzyme deficiencies are present in peripheral blood mononuclear cells of HIV-infected patients with HAART-related lipodystrophy. Antivir Ther 2003, 8:333-8.
Moyle GJ, Sadler M. Peripheral neuropathy with nucleoside antiretrovirals: risk factors, incidence and management. Drug Safety 1998, 19:481-94.
Moyle GJ, Sabin CA, Cartledge J, et al. A randomized, comparative trial of tenofovir DF or abacavir as replacement for a thymidine analogue in persons with lipoatrophy. AIDS 2006, 20: 2043-50.
Negredo E, Moltó J, Burger D, et al. Unexpected CD4 cell count decline in patients receiving didanosine and tenofovir-based regimens despite undetectable viral load. AIDS 2004, 18:459-63.
Noguera A, Fortuny C, Sanchez E, et al. Hyperlactatemia in human immunodeficiency virus-infected children receiving antiretroviral treatment. Pediatr Infect Dis J 2003, 22:778-82.
Parsonage MJ, Wilkins EG, Snowden N, Issa BG, Savage MW. The development of hypophosphataemic osteomalacia with myopathy in two patients with HIV infection receiving tenofovir therapy. HIV Med 2005;6:341-6.
Ray AS, Olson L, Fridland A. Role of purine nucleoside phosphorylase in interactions between 2′,3′-dideoxyinosine and allopurinol, ganciclovir, or tenofovir. Antimicrob Agents Chemother 2004, 48:1089-95.
Saada A, Shaag A, Mandel H, Nevo Y, Eriksson S, Elpeleg O. Mutant mitochondrial thymidine kinase in mitochondrial DNA depletion myopathy. Nat Genet 200, 29:342-4
Saint-Marc T, Touraine JL. The effects of discontinuing stavudine therapy on clinical and metabolic abnormalities in patients suffering from lipodystrophy. AIDS 1999, 13:2188-9.
Setzer B, Schlesier M, Thomas AK, Walker UA. Mitochondrial toxicity of nucleoside analogues in primary human lymphocytes. Antivir Ther 2005a; 10: 327-334.
Setzer B, Schlesier M, Walker UA. Effects of of didanosine-related depletion of mtDNA in human T lymphocytes. J Infect Dis 2005b; 191: 848-855.
Setzer B, Lebrecht D, Walker UA. Pyrimidine nucleoside depletion sensitizes to and is a consequence of the mitochondrial hepatotoxicity of the reverse transcriptase inhibitor stavudine. Am J Pathol 2008, 172:681-90.
Shiramizu B, Shikuma KM, Kamemoto L, et al. Placenta and cord blood mitochondrial DNA toxicity in HIV-infected women receiving nucleoside reverse transcriptase inhibitors during pregnancy. J Acquir Immune Defic Syndr 2003, 32:370-4.
Simpson DM, Tagliati M. Nucleoside analogue-associated peripheral neuropathy in human immunodeficiency virus infection. J Acquir Immune Defic Syndr 1995, 9:153-61.
Sommadossi JP, Carlisle R, Schinazi RF, Zhou Z. Uridine reverses the toxicity of 3′-azido-3′-deoxythymidine in normal human granulocyte-macrophage progenitor cells in vitro without impairment of antiretroviral activity. Antimicrob Agents Chemother 1988. 32:997-1001.
Sternfeld T, Lorenz A, Schmid M, et al. [(13)C]Methionine breath test as a marker for hepatic mitochondrial function in HIV-infected patients. AIDS Res Hum Retroviruses 2009; 25:1243-8.
Sutinen J, Walker UA, Sevastianova K, et al. Uridine supplementation for the treatment of antiretroviral therapy-associated lipoatrophy: a randomized, double-blind, placebo-controlled trial. Antivir Ther 2007;12:97-105.
Tardieu M, Brunelle F, Raybaud C et al. Cerebral MR imaging in uninfected children born to HIV-seropositive mothers and perinatally exposed to zidovudine. AJNR Am J Neuroradiol 2005; 26: 695-701.
Tenofovir review team. Memorandum. www fda gov 2001. 1. http://www.fda.gov/ohrms/dockets/ac/01/slides/3792s1_02_FDA-tenofovir.ppt
van Groeningen CJ, Leyva A, Kraal I, Peters GJ, Pinedo HM. Clinical and pharmacokinetic studies of prolonged administration of high-dose uridine intended for rescue from 5-FU toxicity. Cancer Treat Rep 1986, 70:745-50.
Venhoff N, Setzer B, Lebrecht D, Walker UA. Dietary supplements in the treatment of NRTI-related mitochondrial toxicity. AIDS 2002, 16:800-2.
Venhoff N, Zilly M, Lebrecht D et al. Uridine pharmacokinetics of Mitocnol, a sugar cane extract. AIDS 2005; 19: 739-40.
Venhoff N, Walker UA. Mitochondrial disease in the offspring as a result of antiviral therapy. Exp Opin Drug Saf 2006; 5:373-81.
Venhoff N, Venhoff AC, Jayewardene AL et al. Pharmacokinetics of zidovudine and lamivudine under oral uridine supplementation with Nucleomaxx. J Acquir Immune Defic Syndr 2008:48:114-6.
Venhoff N, Lebrecht D, Deveaud C et al. Oral uridine supplementation antagonizes the peripheral neuropathy and encephalopathy induced by antiretroviral nucleoside analogues. AIDS 2010; 24:345-52.
Walker UA, Byrne E. The therapy of respiratory chain encephalomyopathy: a critical review of the past and current perspective. Acta Neurol Scand 1995, 92:273-280.
Walker UA, Setzer B, Venhoff N. Increased long-term mitochondrial toxicity in combinations of nucleoside analogue reverse-transcriptase inhibitors. AIDS 2002a, 16:2165-73.
Walker UA, Bickel M, Lütke-Volksbeck SI, et al. Evidence of nucleoside analogue reverse transcriptase inhibitor-associated genetic and structural defects of mitochondria in adipose tissue of HIV-infected patients. J AIDS 2002b, 29:117-21.
Walker UA, Venhoff N, Koch E, et al. Uridine abrogates mitochondrial toxicity related to nucleoside analogue reverse transcriptase inhibitors in HepG2 cells. Antivir Ther 2003, 8:463-70.
Walker UA, Bäuerle J, Laguno M et al. Depletion of mitochondrial DNA in liver under antiretroviral therapy with didanosine, stavudine, or zalcitabine. Hepatology 2004a, 39:311-17.
Walker UA, Langmann P, Miehle et al. Beneficial effects of oral uridine in mitochondrial toxicity. AIDS 2004b, 18:1085-6.
Walker UA, Hoffmann C, Enters M, et al. High serum urate in HIV-infected persons. The choice of the antiretroviral drug matters. AIDS 2006a 13: 1556-8.
Walker UA, Auclair M, Lebrecht D, Kornprobst M, Capeau J, Caron M. Uridine abrogates the adverse effects of stavudine and zalcitabine on adipose cell functions. Antivir Ther 2006b, 11: 25-34.
Wanner DP, Tyndall A, Walker UA. Tenofovir induced osteomalacia. Clin Exp Rheumatol 2009; 6: 1001-3
Weinberg ME, Roman MC, Jacob P. et al. Single-dose and cumulative pharmacokinetics of the food supplement NucleomaxX® and mechanism for enhanced bioavailability of uridine. PLOS one 2011 in press