– Christian Hoffmann, Christian Noah –
Welche Laborparameter sollten routinemäßig kontrolliert werden? Welche Werte sind dabei zu erwarten? Im Folgenden werden Viruslast, CD4-Zellen, Routinechecks und Plasmaspiegel kurz besprochen. Zu Resistenz- und Tropismustests siehe das Kapitel Resistenzen. Zur Erstvorstellung, bei der umfangreichere Untersuchungen sinnvoll sind, siehe ebenfalls das entsprechende Kapitel.
Viruslast
Die Viruslast, auch als „Virusload“ oder „Viral load“ bezeichnet, gibt die Viruskonzentration pro Milliliter im Blut an. Neben der CD4-Zellzahl ist die Viruslast zum wichtigsten Surrogatmarker der HIV-Infektion geworden (Hughes 1997, Mellors 1997, Lyles 2000, Ghani 2001, Phillips 2004). Sie liefert Hinweise darauf, wie hoch das Risiko einer Krankheitsprogression ist und ob eine antiretrovirale Therapie notwendig ist. Vor allem aber ist sie der entscheidende Wert für die Frage, ob eine Therapie erfolgreich ist. Gemessen wird bei der Viruslastbestimmung die Menge der HIV-RNA (Erbsubstanz des Virus), die direkt mit der Anzahl der Viren korreliert. Sie wird in Viruskopien/ml (andere Bezeichnung: Genomäquivalente) angegeben. Diese ist entweder eine natürliche, ganze Zahl oder eine logarithmische Zahl. Von einer Veränderung um eine oder mehrere „Logstufen“ ist die Rede, wenn die Viruslast um eine oder mehrere Zehnerpotenzen ansteigt oder absinkt.
| Kopienzahl | Log10 |
| 10 | 1,0 |
| 50 | 1,7 |
| 100 | 2,0 |
| 500 | 2,7 |
| 1.000 | 3,0 |
| 10.000 | 4,0 |
| 50.000 | 4,7 |
| 100.000 | 5,0 |
| 1.000.000 | 6,0 |
Viele Labore sind dazu übergegangen, beide Werte, also die ganze Zahl und den Logarithmus, anzugeben. Anders als bei der HCV- bzw. HBV-Infektion hat sich die standardisierte Angabe der Viruslast in Internationalen Einheiten/ml (International units/ml) bisher nicht durchgesetzt.
Bewertung
Je höher die Viruslast, desto größer ist das Risiko, dass die CD4-Zellen abfallen und es zu einer Krankheitsprogression bzw. zu AIDS-Erkrankungen kommt (Mellors 1997, Lyles 2000, Phillips 2004). Eine Viruslast von über 100.000 Kopien/ml (gelegentlich auch schon ab über 50.000 Kopien/ml) bzw. 5,0 log wird als hoch eingestuft. Eine Viruslast von unter 10.000 Kopien/ml (gelegentlich auch unter 5.000 Kopien/ml) gilt dagegen als niedrig. Die Grenzen sind dabei jedoch fließend. Sie können nur grobe Richtwerte liefern. Individuell kann sich die Höhe der Plasmavirämie sehr unterschiedlich auf den Immunstatus auswirken. Es gibt Patienten, bei denen die CD4-Zellen auch trotz hoher Viruslast relativ lange stabil bleiben, während bei anderen Patienten trotz vermeintlich eher niedriger Viruslast ein schneller Abfall zu beobachten ist. Sogar bei so genannten Elite Controllers, jenen Patienten, deren Viruslast auch ohne ART außerordentlich niedrig ist, wird oft ein Abfall der CD4-Zellen beobachtet (Stellbrink 2008). Wahrscheinlich ist die Viruslast bei Frauen etwas niedriger als bei Männern. In einer Metaanalyse lag der Unterschied bei 41 % bzw. 0,23 log (95 % Konfidenzintervall 0,16-0,31 log) (Napravnik 2002). Der Grund ist unklar. Ob sich dieses Phänomen auf die Therapieindikation auswirken soll, wird noch diskutiert.
Die Methoden
Für die Messung der Viruslast stehen drei kommerziell genutzte Methoden zur Verfügung. In Deutschland wird die RT-PCR (Reverse Transcription Polymerase Chain Reaction) am häufigsten verwendet. Weniger genutzt werden die b-DNA (Branched DNA) oder NASBA (Nucleic Acid Sequence-Based Amplification).
Die Methoden unterscheiden sich sowohl hinsichtlich ihrer Nachweisgrenzen als auch hinsichtlich des linearen Bereichs, innerhalb dessen eine Messung zuverlässig bzw. reproduzierbar ist. Bei der RT-PCR und der NASBA wird ein kurzer Abschnitt der viralen RNA enzymatisch umgewandelt und vervielfältigt. Nach Bindung von markierten DNA-Fragmenten (Sonden) erfolgt dann die Detektion. Bei der b-DNA ist kein enzymatischer Schritt notwendig – die Detektion geschieht direkt über die Bindung von DNA-Sonden an die virale RNA (siehe Tabelle).
Der Markt der Testsysteme ist derzeit sehr dynamisch. Neue Testsysteme werden verfügbar, vorhandene weiter entwickelt. So bietet Siemens zusätzlich zur b-DNA-Technologie auch eine RT-PCR an. Roche setzt weiterhin auf die RT-PCR, will diese aber durch Anwendung der sogenannten „Dual-Target-Detektion“ sicherer machen. Das bedeutet: Es wird nicht – wie bisher – ein Abschnitt der viralen RNA, sondern gleich zwei Abschnitte vervielfältigt. Versagt die Vervielfältigung in einem Abschnitt infolge der hohen Variabilität des HIV-Genoms (das Ergebnis wäre in diesem Fall falsch negativ), greift die Vervielfältigung im zweiten Abschnitt. Darüber hinaus versuchen neben den etablierten Herstellern auch andere Firmen wie Qiagen Marktanteile zu gewinnen. Wie zuverlässig deren Testsysteme sind, muss die Praxis jedoch erst noch zeigen.
Aktuelle Weiterentwicklungen betreffen auch eine Reduktion der Nachweisgrenze, die beim sensitivsten Test derzeit bei 20 Kopien/ml liegt. Die klinische Relevanz einer Viruslast unterhalb von 50 Kopien/ml ist mangels validierter Daten jedoch fraglich. Zu beachten ist auch, dass eine höhere Sensitivität zu einer Verunsicherung von Patienten und Behandlern bzw. zu häufigeren Kontrolluntersuchungen führen kann.
Grundsätzlich ist die Intra-Assay-Varianz der Testsysteme gut, allerdings sollten die messbedingten Schwankungen berücksichtigt werden. So gelten Veränderungen von weniger als 0,5 Logstufen als nicht signifikant. Dies bedeutet, dass ein Rückgang von zum Beispiel 4,3 auf 3,9 log/ml (entspricht ca. 20.000 auf 8.000 Viruskopien/ml) keinen relevanten Abfall der Viruslast anzeigt. Das Gleiche gilt auch für einen Anstieg. Änderungen um fast das Dreifache sind damit nicht relevant! Auf diesen Umstand sollten die Patienten, die sich durch die Bekanntgabe bloßer Zahlen häufig unnötig ängstigen oder euphorisiert werden, hingewiesen werden.
Zwischen den Ergebnissen der verschiedenen Messmethoden können erhebliche Unterschiede liegen (Coste 1996). Es ist daher oft ungünstig, wenn die Methode gewechselt wird. Die Werte der b-DNA sind oft um den Faktor 2 niedriger als die PCR-Werte. Außerdem werden bestimmte Subtypen durch die Verfahren unterschiedlich gut detektiert (Parekh 1999). Vor allem bei Patienten aus Afrika und Asien mit Non-B-Subtypen sollte man wachsam sein, wenn zum Beispiel eine Viruslast bei Erstbestimmung unverhältnismäßig niedrig erscheint. Hier kann dann ausnahmsweise der Wechsel der Methode sinnvoll sein. Allerdings sind neuere Versionen durch verbesserte Primer meist in der Lage, auch ungewöhnliche HIV-Subtypen sensitiv zu messen. Zu beachten ist auch, dass alle Messmethoden einen linearen Bereich haben, außerhalb dessen eine genaue Zahlenangabe nicht möglich ist. Es gilt die Regel: eine Methode, ein Labor! Das Labor sollte außerdem Erfahrung haben bzw. eine ausreichend große Zahl von Messungen machen.
Das Plasma für die Viruslastbestimmung sollte innerhalb eines Tages nach der Blutabnahme vom Vollblut getrennt werden. Die Proben sollten also zügig ins Labor gebracht werden. Alternativ kann das Vollblut auch vor Ort zentrifugiert, eingefroren und schließlich gekühlt transportiert werden. Die Viruslastbestimmung ist kontaminationsanfällig: Wenn im Labor weitere Untersuchungen wie z.B. die Bestimmung der CD4-Zellzahl durchgeführt werden, ist es empfehlenswert, für die Analyse der Viruslast grundsätzlich ein separates EDTA-Blutröhrchen einzuschicken. Im Zweifel sollte das kooperierende Labor kontaktiert werden.
| Tabelle 11.1: Die wichtigsten Testsysteme zur Viruslastbestimmung im Vergleich | |||||
| Hersteller |
Test |
Technologie |
Nachweisgrenze (Kop./ml) |
Linearer Messbereich (Kopien/ml) |
|
| Roche Diagnostics |
COBAS TaqMan HIV-1 Test; v2.0 |
RT-PCR |
20 |
20 – 10.000.000 |
|
| Siemens Healthcare Diagnostics |
Versant HIV-1 RNA 1.0 Assay (kPCR) |
RT-PCR |
37 |
37 – 11.000.000 |
|
| Abbott Molecular |
Abbott RealTime HIV-1 |
RT-PCR |
40 |
40 – 10.000.000 |
|
| Siemens Healthcare Diagnostics |
Versant HIV-1 RNA 3.0 Assay (bDNA) |
b-DNA |
65 |
50 – 500.000 |
|
| Biomérieux |
NucliSENS EasyQ HIV v. 2.0 |
NASBA |
250 |
25 – 7.900.000 |
|
Einflussfaktoren
Neben den methodisch bedingten Schwankungen kann eine ganze Reihe von Faktoren die Höhe der Viruslast zusätzlich beeinflussen. Hierzu zählen zum Beispiel Impfungen und interkurrente Infekte. Während manifester opportunistischer Infektionen ist die Viruslast oft besonders hoch. In einer Studie zeigte sich bei aktiver Tuberkulose eine Erhöhung um das 5- bis 160-fache (Goletti 1996). Auch während einer Lues kann die Viruslast zumindest bei Patienten ohne ART deutlich ansteigen, um nach erfolgreicher Lues-Therapie wieder zu sinken (Buchacz 2004, Kofoed 2006, Palacios 2007). In einer großen retrospektiven Analyse waren in 26 % interkurrierende Infekte die Ursache für transiente Virämien bei antiretroviral behandelten Patienten (Easterbrook 2002). In diesen Situationen ist die Höhe der Viruslast somit nur eingeschränkt verwertbar.
Nach Impfungen gegen Influenza (O’Brien 1995) oder Pneumokokken (Farber 1996), aber auch bei anderen Vakzinen kann die Viruslast ebenfalls vorübergehend erhöht sein (Kolber 2002). Da der Peak eine bis drei Wochen nach der Impfung liegt, sollten Routine-Viruslastmessungen bis zu vier Wochen nach einer Impfung vermieden werden. Zu beachten ist, dass nicht jeder Anstieg ein virologisches Therapieversagen und Resistenzen anzeigen muss. Vorübergehende, leichte Anstiege der Viruslast im Sinne sogenannter Blips haben meist keine Bedeutung (siehe Kapitel Therapieziele). Nicht zuletzt sollte man immer auch an eine mögliche Verwechslung der Proben denken. Unplausible Werte sollten zuerst mit dem Labor besprochen werden und anschließend, wenn dort keine Ursache sichtbar wird, kontrolliert werden – wo Menschen arbeiten, passieren Fehler. Sollten einmal Zweifel am Ergebnis einer Viruslastbestimmung bestehen, sollte jedes Labor auf Anfrage in der Lage und bereit sein, die Untersuchung zu wiederholen oder einen Teil der Probe an ein kooperierendes Labor zu senden, welches ein anderes Testsystem verwendet.
Viruskinetik unter ART
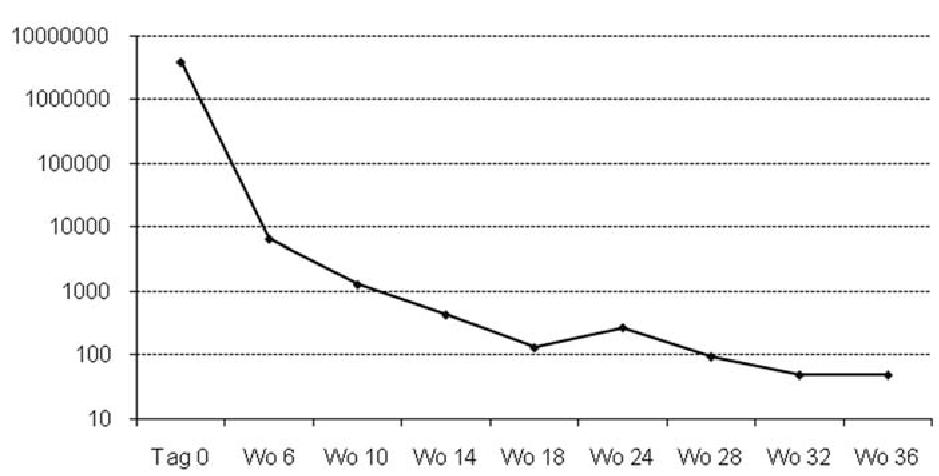
Die Einführung der Viruslast 1996-1997 hat die HIV-Therapie grundlegend verändert. Seit den bahnbrechenden Arbeiten der Arbeitsgruppe um David Ho weiß man um die hohe Dynamik der HIV-Infektion (Ho 1995, Perelson 1996). Wie dynamisch der Prozess aus Virusproduktion und Elimination ist, lässt sich an der Viruslast unter antiretroviraler Therapie erkennen. Die Konzentration von HIV-1 im Plasma ist nach zwei Wochen meist schon um 99 % reduziert (Perelson 1997). In einer großen Kohorte lagen 84 % der Patienten nach vier Wochen bereits unter 1.000 Kopien/ml. Der Abfall folgt einer biphasischen Kinetik. In der ersten Phase in den ersten drei bis sechs Wochen ist ein rascher Abfall zu beobachten, anschließend sinkt die Viruslast nur noch allmählich (Wu 1999). Je höher die Viruslast zum Therapiebeginn, desto länger dauert es, bis sie unter der Nachweisgrenze ist. In einer Studie lag die Spannbreite zwischen 15 Tagen bei einer Baseline-Viruslast von 1.000 gegenüber 113 Tagen bei 1 Million Viruskopien/ml (Rizzardi 2000). Ein typischer Abfall der Viruslast bei anfänglich hoher Viruslast (fast 4 Mio. Kopien/ml) ist in der Abbildung 1 dargestellt.
Viele Studien haben sich mit der Frage beschäftigt, ob sich ein dauerhafter Therapieerfolg schon früh ablesen lässt (Demeter 2001, Kitchen 2001, Lepri 2001, Thiebaut 2000). In einer Studie an 124 Patienten war ein Abfall um weniger als 0,72 Logstufen nach einer Woche in mehr als 99 % der Patienten prädiktiv für ein virologisches Therapieversagen (Polis 2001). Auch in einer anderen prospektiven Studie ließ sich das virologische Ansprechen nach 48 Wochen schon nach 7 Tagen voraussagen (Haubrich 2007). Praktische Relevanz haben diese Beobachtungen indes eher wenig. Aus unserer Sicht macht es keinen Sinn, die Viruslast schon nach einer oder zwei Wochen zu messen.
Abbildung 1: Typischer, biphasischer Abfall der Viruslast unter ART. Initial bestand eine hohe Viruslast, und erst zur Woche 32 lag die Viruslast erstmals unter 50 Kopien. Man beachte den kurzfristigen Anstieg zur Woche 24, der möglicherweise auf methodisch bedingte Schwankungen zurückzuführen war. Die ART wurde nicht verändert.
Nach den Deutsch-Österreichischen Leitlinien sollte die Viruslast in den ersten Monaten nach Therapiebeginn im Abstand von vier Wochen gemessen werden, bis sie unter die Nachweisgrenze von 20-50 Kopien/ml gesunken ist. Anschließend reicht eine Messung alle drei bis vier Monate. Eventuell sind auch noch längere Intervalle möglich (Chaiwarith 2010). Bei Wiederanstieg bzw. nach Therapieumstellung sind natürlich auch kurzfristige Kontrollen notwendig. Innerhalb der ersten 4 Wochen nach Therapiebeginn sollte die Viruslast mindestens um den Faktor 100 zurückgehen und nach 3-4 Monaten (bei hoher Ausgangsviruslast nach 6 Monaten) unter die Nachweisgrenze sinken.
Die Viruslast kann auch in anderen Körperflüssigkeiten als Blut oder Plasma (zum Beispiel Liquor, Vaginal- oder Spermaflüssigkeit) gemessen werden. Allerdings wurden die verfügbaren Testsysteme für solche Materialien von keinem Hersteller validiert, d.h. die Testsysteme sind dafür nicht zugelassen.
Praktische Tips im Umgang mit der Viruslast (s. auch Therapieziele)
- Möglichst bei einer Messmethode bleiben
- Möglichst bei einem erfahrenen Labor bleiben, keine „home-brewed Assays“
- Methodisch bedingte Messschwankungen (bis zu einer halben Logstufe) berücksichtigen und dem Patienten erklären!
- Unter einer neuen ART die Viruslast zunächst alle 4 Wochen messen, bis die Viruslast unter der Nachweisgrenze liegt
- Viruslast dann seltener messen – unter stabiler ART reichen alle 3 Monate
- Ohne ART genügen ebenfalls meistens Messungen alle drei Monate
- Nicht kurz nach Impfungen oder bei interkurrenten Infekten messen
- Unplausible Werte nach 2-4 Wochen kontrollieren, an die Subtypen-Unterschiede denken (hier kann ein Wechsel der Methode sinnvoll sein)
CD4-Zellen
CD4-Zellen sind T-Lymphozyten, die den Oberflächenrezeptor CD4 besitzen (siehe Grundlagen). Diese Lymphozyten-Subpopulation wird auch als „Helfer-Zellen“, mitunter auch als T-Helfer-Zellen bezeichnet. Die Messung der CD4-Zellen ist neben der Viruslast der weitaus wichtigste Surrogatmarker in der HIV-Medizin. Sie erlaubt sehr zuverlässig eine Einschätzung des individuellen Risikos, an AIDS zu erkranken. Einen HIV-Patienten ohne CD4-Zellzahlen in den letzten sechs Monaten „darf es nicht geben“! Als grobe Richtwerte gelten zwei Werte: Oberhalb von 400-500 CD4-Zellen/µl sind schwere AIDS-Erkrankungen selten. Unterhalb von 200 CD4-Zellen/µl steigt mit zunehmender Dauer der Immunsuppression das Risiko für AIDS-Erkrankungen deutlich an. Die meisten AIDS-Erkrankungen treten allerdings erst unter 100 CD4-Zellen/µl auf.
Bei der Bestimmung der CD4-Zellen (meist mittels Flowzytometrie) sind einige Dinge zu beachten. So sollte das Blut relativ frisch abgenommen und nicht älter als 18 Stunden sein. Je nach Labor liegen die Untergrenzen der Normalwerte zwischen 400 und 500 Zellen/µl. Wie bei der Viruslast gilt auch bei den CD4-Zellen: Man sollte immer bei einem Labor (mit Erfahrung) bleiben. Je höher die Werte, desto größer sind die Schwankungen. Abweichungen von 50-100 CD4-Zellen/µl sind ohne weiteres möglich. In einer Studie lagen die 95 % Konfidenzintervalle bei einem echten Wert von 500/µl zwischen 297 und 841/µl. Bei 200 CD4-Zellen/µl lag das 95 % Konfidenzintervall zwischen 118 und 337/µl (Hoover 1993).
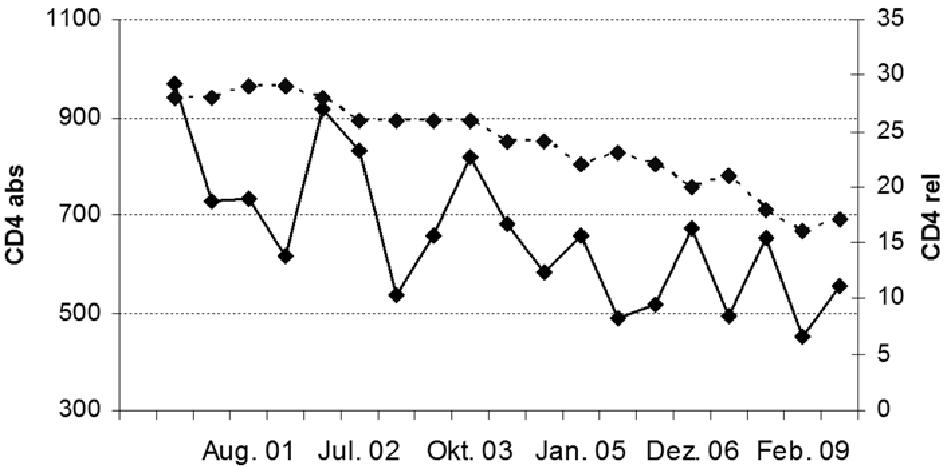
Abbildung 2: Langsamer Abfall der absoluten und relativen (gestrichelt) CD4-Zellen über fast zehn Jahre hinweg bei einem unbehandelten Patienten. Man beachte die Schwankungen bei den absoluten Zahlen.
Die Messung der CD4-Zellen sollten bei unplausiblen Werten wiederholt werden. Sofern die Viruslast unter der Nachweisgrenze liegt, braucht man sich auch von größeren Abfällen der CD4-Zellen nicht irritieren zu lassen. Hier bietet sich meist auch ein Blick auf die relativen Werte (CD4-Prozente) sowie die CD4/CD8-ratio (Verhältnis von CD4-Zellen zu CD8-Zellen) an, die meist robuster bzw. weniger störanfällig sind. Als grober Anhaltspunkt kann gelten: Bei über 500 CD4-Zellen/µl sind relative Werte über 29 % zu erwarten, bei unter 200 CD4-Zellen/µl unter 14 %. Auch die Normalwerte für relative Werte und die Ratio sind je nach Labor unterschiedlich definiert. Wenn erhebliche Diskrepanzen zwischen absoluten und relativen CD4-Zellen bestehen, sollte man mit Therapieentscheidungen vorsichtig sein – lieber einmal mehr kontrollieren! Auch sollte das übrige Differentialblutbild genau analysiert werden: Liegt eine Leukopenie oder eine Leukozytose vor?
Behandler vergessen heute oft, dass die Mitteilung der CD4-Zellen für viele Patienten noch immer von existentieller Bedeutung ist. Der Gang zum Arzt und das Gespräch über die Werte wird von vielen Patienten als sehr belastend („schlimmer als Zeugnisse“) empfunden. Die unreflektierte Mitteilung vermeintlich schlechter Werte kann zu einer reaktiven Depression führen. Es ist daher sehr wichtig, den Patienten über die physiologischen und methodenbedingten Schwankungen zu informieren. Ein Abfall von 1.200 auf 900 Zellen/µl ist meist ohne Bedeutung! Für viele Patienten ist die Mitteilung solcher Werte dagegen eine Katastrophe. Auch bei „Ausreißern“ nach oben sollte auf die Euphoriebremse getreten werden. Man spart so langfristig nicht nur Zeit bzw. Diskussionen – den Patienten erspart es ein Wechselbad der Gefühle. Die Mitteilung von Werten durch nichtärztliches Personal (ohne fundierte HIV-Kenntnisse) halten wir grundsätzlich für problematisch.
Sind erst einmal Normwerte und eine ausreichende Virussuppression erreicht, reichen unserer Meinung nach auch halbjährliche Bestimmungen aus. Die Wahrscheinlichkeit, dass die CD4-Zellen dann auf Bereiche unter 350/μl sinken, ist extrem gering (Phillips 2003). Die Patienten, die dennoch eine häufigere Kontrolle des Immunstatus wünschen, kann man meist mit dem Hinweis beruhigen, dass mit den CD4-Zellen nichts Schlechtes passieren kann, solange HIV unterdrückt bleibt.
Einflussfaktoren
Neben den laborbedingten Schwankungen gibt es eine Reihe weiterer Einflussfaktoren. Dazu zählen interkurrente Infekte, Leukopenien unterschiedlicher Genese und Steroide bzw. jegliche immunsuppressive Therapie. Während opportunistischer Infektionen, aber auch während einer Lues sind die CD4-Zellen erniedrigt (Kofoed 2006, Palacios 2007). Auch extreme Anstrengungen (Marathon-Lauf!), chirurgische Eingriffe oder eine Schwangerschaft führen vorübergehend zu niedrigeren Werten. Sogar die Tageszeit kann eine Rolle spielen. Seit langem weiß man, dass die CD4-Zellen mittags niedrig, abends gegen 20 Uhr am höchsten sind (Malone 1990). Psychischer Stress spielt, wie von vielen Patienten oft angenommen, dagegen kaum oder allenfalls eine geringe Rolle.
Kinetik der CD4-Zellen unter ART
Der Anstieg der CD4-Zellen verläuft biphasisch (Renaud 1999, Le Moing 2002): nach einem raschen Anstieg in den ersten drei bis vier Monaten ist der CD4-Zellgewinn anschließend geringer. In einer Untersuchung an fast 1.000 Patienten stiegen die CD4-Zellen während der ersten 3 Monate monatlich um 21/µl. In den folgenden 21 Monaten waren es nur noch 5,5 CD4-Zellen/µl pro Monat (Le Moing 2002). Der anfänglich rasche Anstieg der CD4-Zellen wird möglicherweise durch eine Umverteilung verursacht. Ihm schließt sich eine Neuproduktion naiver T-Zellen an (Pakker 1998). Eventuell spielt anfangs auch eine verminderte Apoptose eine Rolle (Roger 2002).
Ob sich das Immunsystem auch nach langer Zeit der Viruslastsuppression kontinuierlich weiter restauriert oder ob möglicherweise nach drei oder vier Jahren ein Plateau erreicht wird, über das hinaus es keinen weiteren Anstieg gibt, wird kontrovers diskutiert (Smith 2004, Viard 2004). Viele Faktoren beeinflussen das Ausmaß der Immunrekonstitution. Wichtig ist der Grad der Virussuppression – je niedriger die Viruslast, desto besser ist der Effekt (Le Moing 2002). Auch ist der absolute Anstieg umso höher, je höher die CD4-Zellen zu ART-Beginn sind (Kaufmann 2000). Auch die bei Therapiebeginn noch vorhandenen naiven T-Zellen bestimmen die langfristige Immunrekonstitution mit (Notermans 1999).
Wichtig ist außerdem das Lebensalter (Grabar 2004). Je größer der Thymus und je aktiver die Thymopoese, desto deutlicher ist der Anstieg (Kolte 2002) – aufgrund der häufig im Alter beobachteten Thymusdegeneration steigen die CD4-Zellen bei älteren Menschen nicht so wie bei jüngeren Patienten (Viard 2001). Allerdings haben wir auch schon 20jährige Patienten mit einer sehr schlechten CD4-Zell-Restauration gesehen – und umgekehrt 60jährige Patienten mit sehr guten, überdurchschnittlichen CD4-Zellanstiegen. Die Regenerationsfähigkeit des menschlichen Immunsystems ist individuell sehr unterschiedlich, und bis heute gibt es keine Methode, diese Kapazität verlässlich vorherzusagen.
Wahrscheinlich gibt es antiretrovirale Therapien wie zum Beispiel DDI+Tenofovir, bei denen die Immunrekonstitution weniger gut ist als bei anderen. Ob letztere besonders gut ist unter CCR5-Antagonisten, wird derzeit in einigen Studien geklärt. Auch immunsuppressive Begleitmedikationen müssen beachtet werden, sie können die Immunrekonstitution beeinträchtigen (siehe das Kapitel Therapieprinzipien).
Praktische Hinweise zum Umgang mit CD4-Zellen
- Wie bei der Viruslast gilt: bei einem Labor (mit Erfahrung) bleiben.
- Je höher die Werte, desto größer die Schwankungen (viele Einflussfaktoren) – immer die relativen Werte und CD4/CD8-ratio mit Vorbefunden vergleichen!
- Sich (und die Patienten) nicht durch vermeintliche Abfälle verrückt machen lassen – bei suffizienter Virussuppression kann der Abfall nicht HIV-bedingt sein! Nerven behalten! Nur sehr unplausible Werte sollten wiederholt werden.
- Wenn die Viruslast unter der Nachweisgrenze ist, reichen dreimonatliche Bestimmungen der CD4-Zellen.
- Bei guter Virussuppression und normalen CD4-Zellen kann man die CD4-Zellen (nicht die Viruslast!) auch seltener kontrollieren.
- CD4-Werte und Viruslast sollten mit dem Arzt besprochen werden. Patienten mit den Werten nicht alleine lassen.
Über die CD4-Zellen hinaus gibt es weiterführende Untersuchungen, mit denen die qualitative bzw. funktionelle Kapazität des Immunsystems gegenüber spezifischen Antigenen detaillierter getestet wird (Telenti 2002). Diese meist recht aufwendigen Methoden sind jedoch in der Routine-Diagnostik derzeit nicht notwendig, ihr Nutzen noch fraglich. Sie könnten allerdings eines Tages helfen, den individuellen Zustand des Immunsystems besser zu beschreiben und jene (wenigen) Patienten identifizieren, die bei vermeintlich guten CD4-Zellen gefährdet sind, an opportunistischen Infektionen zu erkranken.
Routine-Checks – was sonst kontrollieren?
Neben CD4-Zellen und Viruslast sind noch weitere Werte zu kontrollieren. Die folgenden Empfehlungen gelten für den klinisch beschwerdefreien Patienten mit Normwerten im Routine-Labor, der entweder unter einer seit mehreren Monaten stabilen Therapie steht oder keine ART einnimmt. Wenn eine Therapie begonnen bzw. umgestellt wird oder Beschwerden bestehen, sind selbstverständlich häufigere und, je nach Problem, weitere Untersuchungen erforderlich.
Vor allem eine körperliche Untersuchung sollte regelmäßig stattfinden. Nicht selten fallen erst anlässlich solcher Untersuchungen wichtige Befunde wie zum Beispiel Kaposi-Läsionen, Condylome oder Mykosen (Soor!) auf. Je niedriger die CD4-Zellen liegen, desto häufiger sollten die Patienten körperlich untersucht werden.
| Tabelle 11.2: Jährliches Minimalprogramm bei stabilen Werten und Beschwerdefreiheit | ||
|
Unter ART, pro Jahr |
Untherapiert, pro Jahr |
|
| Blutbild, LDH, GPT, Krea, Bili, Lipase, yGT, Glukose |
4-6 x |
2-4 x |
| Viruslast |
4 x |
2-4 x |
| CD4-Zellen |
2-4 x |
2-4 x |
| Lipide |
1-2 x |
1 x |
| Körperliche Untersuchung, Urinstatus |
2-4 x |
1-2 x |
| Gynäkologische Untersuchung |
1 x |
1 x |
| Funduskopie bei CD4-Zellen < 200/µl |
1-2 x |
4 x |
Bei Patienten mit weniger als 200 CD4-Zellen/µl empfehlen wir halb- bis vierteljährlich Funduskopien zum Ausschluss einer CMV-Retinitis. Wünschenswert ist die Zusammenarbeit mit einem HIV-erfahrenen Ophtalmologen. Je besser die CD4-Zellen sind, desto seltener sind Funduskopien notwendig, bei normalen CD4-Zellen kann unserer Meinung nach auch ganz darauf verzichtet werden. Empfohlen werden dagegen CD4-Zell-unabhängig regelmäßige gynäkologische Untersuchungen mit PAP-Abstrichen. Auch rektale Untersuchungen (inklusive Proktoskopien) werden inzwischen von vielen Experten empfohlen, um Präkanzerosen und Analkarzinome rechtzeitig zu entdecken. Derartige Empfehlungen werden allerdings sehr unterschiedlich umgesetzt. Aus unserer Sicht bzw. nach unseren subjektiven Erfahrungen (die vermutlich einigen Vorsorge-Befürwortern zuwiderläuft), sind routinemäßige Röntgen-Untersuchungen, Sonografien (Ausnahme: Patienten mit chronischen Hepatitiden, da hier ein hepatozelluläres Karzinom nicht selten ist!), Serologien oder Laktatmessungen ohne besonderen Anlass nicht erforderlich. Gerade bei noch gutem Immunstatus kann man die Patienten auch einmal in Ruhe lassen.
Ein jährliches EKG ist aus unserer Sicht nur bei besonderem Risikoprofil angezeigt (siehe dazu auch HIV und Herzerkrankungen). Einen Tuberkulin-Test (einmal jährlich Hauttest nach Mendel-Mantoux mit 5 IE) wiederholen wir nur, wenn er initial negativ war. Wichtig ist, dass die bei HIV-negativen Personen allgemein empfohlenen Untersuchungen zur Früherkennung nicht vergessen werden. Dazu zählt zum Beispiel die Früherkennung auf Darmkrebs (ab 55 Jahren alle 10 Jahre eine Coloskopie).
Therapeutisches Drug Monitoring (TDM)
Bei vielen antiretroviralen Substanzen können die Plasmaspiegel aus diversen Gründen (Compliance, Metabolismus, Absorption) erheblich schwanken. Die Messung der Medikamentenkonzentration in Serum oder Plasma wird auch als Therapeutisches Drug Monitoring (TDM) bezeichnet.
Ausreichende Plasmaspiegel sind für den virologischen Therapieerfolg wichtig (Acosta 2000). In der VIRADAPT-Studie war eine ausreichende PI-Konzentration sogar noch wichtiger als die Kenntnis von Resistenzmutationen (Durant 2000). Auch bei NNRTIs sind ausreichende Plasmaspiegel wichtig (Marzolini 2001, Veldkamp 2001). Diese Daten stammen allerdings aus den frühen Jahren der ART.
Ob ein TDM auch heute noch das virologische Ansprechen tatsächlich verbessert, ist jedoch nicht eindeutig bewiesen (Kredo 2009). Große randomisierte Studien, die dieser Frage nachgegangen sind, gibt es nur wenige. Der Nutzen eines TDM bleibt deshalb fraglich, die Methode ist weiterhin als experimentell anzusehen (Review: Liu 2010). In einer der wenigen randomisierten Studien zeigte sich lediglich ein Trend zugunsten eines virologischen Benefits (Best 2007), in einer anderen bei Patienten mit geboosterten PIs blieb TDM gar ohne jeden Effekt (Demeter 2009).
Auf der anderen Seite korrelieren sehr hohe Spiegel auch mit einer erhöhten Rate von Nebenwirkungen. So waren Nierenprobleme unter Indinavir (Dieleman 1999), gastrointestinale Störungen unter Ritonavir (Gatti 1999), Hepatotoxizität unter Nevirapin (Gonzalez 2002) oder ZNS-Probleme unter Efavirenz (Marzolini 2001) mit sehr hohen Plasmaspiegeln assoziiert. TDM wird daher ein Hilfsmittel der Therapieüberwachung bleiben: nicht jede Interaktion zwischen antiretroviralen Substanzen untereinander und mit eventuellen Begleitmedikationen ist untersucht worden.
Nach den Deutsch-Österreichischen Empfehlungen kann in folgenden Situationen eine Messung von Plasmaspiegeln der NNRTIs bzw. PIs sinnvoll sein:
- Multimedikation, komplexe Booster-Therapien
- erheblich über- bzw. untergewichtige Patienten
- Nebenwirkungen
- Therapieversagen (DD: Resistenz)
- Fehlerhafte Medikamenteneinnahme, ungenügende Adhärenz
- intestinale Resorptionsstörungen, Leberfunktionsstörungen
- ART bei Kindern, in der Schwangerschaft
- Once daily-Regime
- Einsatz neuer Substanzen (Risiko neuer Interaktionen)
Gleichwohl gibt es eine Reihe von Problemen, die den breiten Einsatz des TDM noch limitieren. So macht die Messung von NRTIs wenig Sinn, da sie erst intrazellulär in ihre aktiven Metabolite umgewandelt werden. Die intrazelluläre Messung befindet sich noch in der Erprobung. Auch für neue Substanzen wie T-20, Raltegravir oder Maraviroc fehlen bislang noch valide Daten.
Man misst daher derzeit mit den NNRTIs oder PIs oft nur eine Substanz in einer (versagenden) Kombination. Unterschiedlich resistente Virusstämme mit unterschiedlichen Hemmkonzentrationen, variable Proteinbindungen der Substanzen, zeitliche Variabilität der Spiegel, aber auch methodische Probleme mit den Assays sind weitere Probleme. Hinzu kommt das Fehlen klar definierter Grenzwerte. Es bleiben somit nicht unerhebliche Unsicherheiten bei der Beurteilung der Plasmaspiegel. Bis randomisierte Studien vorliegen, die den klinischen Wert des TDM wirklich beweisen, sollte die Messung bzw. die Interpretation der Ergebnisse spezialisierten Zentren vorbehalten bleiben.
Für den Zeitpunkt der Plasmaspiegelmessung ist es wichtig, sich vorher klar zu machen, was man eigentlich mit dem TDM wissen will. Geht es um die mangelnde Effektivität der ART, sind Talspiegel entscheidend, also jene Spiegel, die unmittelbar vor der nächsten Einnahme gemessen werden. Geht es um Toxizität, sollten die Spiegel eher eine bis drei Stunden nach der Einnahme gemessen werden, um die maximalen Konzentrationen zu erfassen.
Literatur
Acosta EP, Kakuda TN, Brundage RC, Anderson PL, Fletcher CV. Pharmacodynamics of HIV type 1 protease inhibitors. Clin Infect Dis 2000, Suppl 2:S151-9.
Best BM, Goicoechea M, Witt MD, et al. A randomized controlled trial of therapeutic drug monitoring in treatment-naive and -experienced HIV-1-infected patients. J AIDS 2007;46:433-42.
Buchacz K, Patel P, Taylor M, et al. Syphilis increases HIV viral load and decreases CD4 cell counts in HIV-infected patients with new syphilis infections. AIDS 2004, 18:2075-2079.
Chaiwarith R, Praparattanapan J, Salee P, et al. Frequency of HIV-RNA Monitoring: impact on outcome of antiretroviral therapy. Abstract 500, 17th CROI 2010, San Francisco.
Clevenbergh P, Mouly S, Sellier P, et al. Improving HIV infection management using antiretroviral plasma drug levels monitoring: a clinician’s point of view. Curr HIV Res 2004, 2:309-21.
Coste J, Montes B, Reynes J, et al. Comparative evaluation of three assays for the quantitation of HIV type 1 RNA in plasma. J Med Virol 1996, 50:293-302.
Demeter LM, Hughes MD, Coombs RW, et al. Predictors of virologic and clinical outcomes in HIV-1-infected patients receiving concurrent treatment with indinavir, zidovudine, and lamivudine. ACTG Protocol 320. Ann Intern Med 2001, 135: 954-64.
Demeter LM, Jiang H, Mukherjee AL, et al. A randomized trial of therapeutic drug monitoring of protease inhibitors in antiretroviral-experienced, HIV-1-infected patients. AIDS 2009, 23:357-68.
Dieleman JP, Gyssens IC, van der Ende ME, de Marie S, Burger DM. Urological complaints in relation to indinavir plasma concentrations in HIV-infected patients. AIDS 1999, 13:473-8.
Durant J, Clevenbergh P, Garraffo R, et al. Importance of protease inhibitor plasma levels in HIV-infected patients treated with genotypic-guided therapy: pharmacological data from the Viradapt Study. AIDS 2000, 14:1333-9.
Easterbrook PJ, Ives N, Waters A, et al. The natural history and clinical significance of intermittent viraemia in patients with initial viral sup-pression to < 400 copies/ml. AIDS 2002; 16:1521-7.
Farber CM, Barath AA, Dieye T. The effects of immunization in HIV type 1 infection. N Engl J Med 1996, 335:817; discussion 818-9.
Gatti G, Di Biagio A, Casazza R, et al. The relationship between ritonavir plasma levels and side-effects: implications for therapeutic drug monitoring. AIDS 1999, 13:2083-9.
Ghani AC, de Wolf F, Ferguson NM, et al. Surrogate markers for disease progression in treated HIV infection. J Acquir Immune Defic Syndr 2001; 28: 226-31..
Goletti D, Weissman D, Jackson RW, et al. Effect of Mycobacterium tuberculosis on HIV replication. Role of immune activation. J Immunol 1996, 157:1271-8.
Gonzalez de Requena D, Nunez M, Jimenez-Nacher I, Soriano V. Liver toxicity caused by nevirapine. AIDS 2002, 16:290-1.
Grabar S, Kousignian I, Sobel A, et al. Immunologic and clinical responses to highly active antiretroviral therapy over 50 years of age. Results from the French Hospital Database on HIV. AIDS 2004, 18:2029-2038.
Haubrich R, Riddler S, Ribaudo H, et al. Initial viral decay to assess the relative antiretroviral potency of PI-, NNRTI-, and NRTI-sparing regimens for first line therapy of HIV-1 infection: ACTG 5160s. Abstract 137, 14th CROI 2007, Los Angeles. Abstract: http://www.retroconference.org/2007/Abstracts/28232.htm
Ho DD, Neumann AU, Perelson AS, et al. Rapid turnover of plasma virions and CD4 lymphocytes in HIV-1 infection. Nature 1995, 373:123-6.
Hoover DR. Would confirmatory retesting of CD4+ cells to verify AIDS status be too expensive? J Acquir Immune Defic Syndr 1993, 6:537-9.
Hughes MD, Johnson VA, Hirsch MS, et al. Monitoring plasma HIV-1 RNA levels in addition to CD4+ lymphocyte count improves assessment of antiretroviral therapeutic response. ACTG 241 Protocol Virology Substudy Team. Ann Intern Med 1997; 126: 929-38.
Kaufmann GR, Bloch M, Zaunders JJ, Smith D, Cooper DA. Long-term immunological response in HIV-1-infected subjects receiving potent antiretroviral therapy. AIDS 2000, 14: 959-69.
Kitchen CM, Kitchen SG, Dubin JA, Gottlieb MS. Initial virological and immunologic response to HAART predicts long-term clinical outcome. Clin Infect Dis 2001; 33: 466-72.
Kofoed K, Gerstoft J, Mathiesen LR, Benfield T. Syphilis and human immunodeficiency virus (HIV)-1 coinfection: influence on CD4 T-cell count, HIV-1 viral load, and treatment response. Sex Transm Dis 2006;33:143-8.
Kolber MA, Gabr AH, De La Rosa A, et al. Genotypic analysis of plasma HIV-1 RNA after influenza vaccination of patients with previously undetectable viral loads. AIDS 2002, 16: 537-42.
Kolte L, Dreves AM, Ersboll AK, et al. Association between larger thymic size and higher thymic output in HIV-infected patients receiving HAART. J Infect Dis 2002, 185:1578-85.
Kredo T, Van der Walt JS, Siegfried N, Cohen K. Therapeutic drug monitoring of antiretrovirals for people with HIV. Cochrane Database Syst Rev 2009, 8;(3):CD007268.
Le Moing V, Thiebaut R, Chene G, et al. Predictors of long-term increase in CD4(+) cell counts in HIV-infected patients receiving a protease inhibitor-containing antiretroviral regimen. J Infect Dis 2002, 185: 471-80.
Lepri AC, Miller V, Phillips AN, et al. The virological response to HAART over the first 24 weeks of therapy according to the pre-therapy viral load and the weeks 4-8 viral load. AIDS 2001, 15: 47-54.
Liu X, Ma Q, Zhang F. Therapeutic drug monitoring in highly active antiretroviral therapy. Expert Opin Drug Saf 2010, 9:743-58.
Lyles RH, Munoz A, Yamashita TE, et al. Natural history of HIV type 1 viremia after seroconversion and proximal to AIDS in a large cohort of homosexual men. J Infect Dis 2000, 181:872-880.
Maggiolo F, Migliorino M, Pirali A. Duration of viral suppression in patients on stable therapy for HIV-1 infection is predicted by plasma HIV RNA level after 1 month of treatment. J Acquir Immune Defic Syndr 2000, 25:36-43.
Malone JL, Simms TE, Gray GC, et al. Sources of variability in repeated T-helper lymphocyte counts from HIV type 1-infected patients: total lymphocyte count fluctuations and diurnal cycle are important. J Acquir Immune Defic Syndr 1990, 3:144-51.
Marzolini C, Telenti A, Decosterd LA, et al. Efavirenz plasma levels can predict treatment failure and central nervous system side effects in HIV-1-infected patients. AIDS 2001, 15: 71-5.
Mellors JW, Munoz AM, Giorgi JV, et al. Plasma viral load and CD4+ lymphocytes as prognostic markers of HIV-1 infection. Ann Intern Med 1997, 126:946-954.
Napravnik S, Poole C, Thomas JC, Eron JJ Jr. Gender difference in HIV RNA levels: a meta-analysis of published studies. J Acquir Immune Defic Syndr 2002, 31:11-9.
Notermans DW, Pakker NG, Hamann D, et al. Immune reconstitution after 2 years of successful potent ART in previously untreated HIV type 1-infected adults. J Infect Dis 1999, 180: 1050-6.
O’Brien WA, Grovit-Ferbas K, Namazi A, et al. HIV-type 1 replication can be increased in peripheral blood of seropositive patients after influenza vaccination. Blood 1995, 86:1082-9.
Pakker NG, Notermans DW, de Boer RJ, et al. Biphasic kinetics of peripheral blood T cells after triple combination therapy in HIV-1 infection: a composite of redistribution and proliferation. Nat Med 1998, 4: 208-14.
Palacios R, Jimenez-Onate F, Aguilar M, et al. Impact of syphilis infection on HIV viral load and CD4 cell counts in HIV-infected patients. J Acquir Immune Defic Syndr 2007;44:356-9.
Parekh B, Phillips S, Granade TC, et al. Impact of HIV type 1 subtype variation on viral RNA quantitation. AIDS Res Hum Retroviruses 1999, 15:133-42.
Perelson AS, Essunger P, Cao Y, et al. Decay characteristics of HIV-1-infected compartments during combination therapy. Nature 1997, 387:188-91.
Perelson AS, Neumann AU, Markowitz M, Leonard JM, Ho DD. HIV-1 dynamics in vivo: virion clearance rate, infected cell life-span, and viral generation time. Science 1996, 271:1582-6.
Phillips A, CASCADE Collaboration. Short-term risk of AIDS according to current CD4 cell count and viral load in antiretroviral drug-naive individuals and those treated in the monotherapy era. AIDS 2004, 18:51-8.
Phillips AN, Youle M, Lampe F, et al. CD4 cell count changes in individuals with counts above 500 cells/mm and viral loads below 50 copies/ml on antiretroviral therapy. AIDS 2002; 16: 1073-5.
Polis MA, Sidorov IA, Yoder C, et al. Correlation between reduction in plasma HIV-1 RNA concentration 1 week after start of antiretroviral treatment and longer-term efficacy. Lancet 2001, 358: 1760-5
Renaud M, Katlama C, Mallet A, et al. Determinants of paradoxical CD4 cell reconstitution after protease inhibitor-containing antiretroviral regimen. AIDS 1999, 13:669-76.
Rizzardi GP, DeBoer RJ, Hoover S, et al. Predicting the duration of antiretroviral treatment needed to suppress plasma HIV-1 RNA. J Clin Invest 2000, 105:777-782.
Roger PM, Breittmayer JP, Durant J, et al. Early CD4(+) T cell recovery in HIV-infected patients receiving effective therapy is related to a down-regulation of apoptosis and not to proliferation. J Infect Dis 2002, 185: 463-70.
Smith CJ, Sabin CA, Youle MS, et al. Factors influencing increases in CD4 cell counts of HIV-positive persons receiving long-term highly active antiretroviral therapy. J Infect Dis 2004, 190:1860-8.
Smith CJ, Staszewski S, Sabin CA, et al. Use of viral load measured after 4 weeks of highly active antiretroviral therapy to predict virologic outcome at 24 weeks for HIV-1-positive individuals. J AIDS 2004, 37:1155-1159.
Stellbrink HJ, Schewe CK, Hoffmann C, Wolf E. Is there a harmless level of plasma viremia in untreated HIV infection? CD4+ T cells in the long-term follow-up of elite controllers and controls. Abstract 351, 14th CROI 2008, Boston
Telenti A. New developments in laboratory monitoring of HIV-1 infection. Clin Microbiol Infect 2002, 8:137-43.
Thiebaut R, Morlat P, Jacqmin-Gadda H, et al. Clinical progression of HIV-1 infection according to the viral response during the first year of antiretroviral treatment. AIDS 2000, 14: 971-8.
Veldkamp AI, Weverling GJ, Lange JM, et al. High exposure to nevirapine in plasma is associated with an improved virological response in HIV-1-infected individuals. AIDS 2001; 15: 1089-95.
Viard JP, Burgard M, Hubert JB, et al. Impact of 5 years of maximally successful highly active antiretroviral therapy on CD4 cell count and HIV-1 DNA level. AIDS 2004, 18:45-9.
Viard JP, Mocroft A, Chiesi A, et al. Influence of age on CD4 cell recovery in HIV-infected patients receiving HAART: evidence from the EuroSIDA study. J Infect Dis 2001, 183: 1290-4.
Walter EA, Gilliam B, Delmar JA, et al. Clinical implications of identifying non-B subtypes of HIV type 1 infection. Clin Infect Dis 2000, 31:798-802.
Wu H, Kuritzkes DR, McClernon DR, et al. Characterization of viral dynamics in HIV type 1-infected patients treated with combination antiretroviral therapy: relationships to host factors, cellular restoration, and virologic end points. J Infect Dis 1999, 179: 799-807.