– von Andrea Rubbert-Roth und Georg Behrens –
Einleitung
Seit der Erstbeschreibung von HIV-1 im Jahr 1983 (Barre-Sinoussi 1983, Gallo 1983) und HIV-2 im Jahr 1986 (Clavel 1986) sind diese beiden Viren als Auslöser der erworbenen Immunschwäche AIDS identifiziert. Trotz aller therapeutischen Fortschritte sind weder Eradikation des Virus noch eine prophylaktische Vakzine in Sicht. Für effizientere Therapie- und Vakzinestrategien ist daher dringend ein besseres Verständnis der Pathophysiologie der HIV-Infektion erforderlich.
Der individuelle Verlauf der HIV-Infektion wird durch virale Faktoren, aber vor allem auch durch Wirtsfaktoren bestimmt. So zeigen Patienten trotz gleicher Infektionsquelle oft sehr unterschiedliche Krankheitsverläufe. Zwar sind in Einzelfällen auch defekte Viren die Ursache für einen günstigen Krankheitsverlauf (Kirchhoff 1995), doch liegen bei der Mehrzahl der Infizierten replikationskompetente Viren mit hohem „turnover” vor. Die Identifizierung bzw. Charakterisierung von Wirtsfaktoren ist deshalb nicht nur für das Verständnis der Pathogenese der HIV-Infektion wesentlich. Sie ist auch mit der Hoffnung verbunden, dass dadurch neue therapeutische und prophylaktische Strategien entwickeln werden können.
Struktur und Aufbau von HIV-1
HIV-1 ist ein Retrovirus und gehört zur Familie der Lentiviren. Infektionen mit Lentiviren verlaufen meist chronisch, zeigen eine lange klinische Latenzphase, eine persistierende Virämie sowie eine Beteiligung des zentralen Nervensystems. HIV-1 und HIV-2 sehen zwar im elektronenmikroskopischen Bild nahezu gleich aus, unterscheiden sich aber hinsichtlich der Molekulargewichte ihrer Proteine und der Anordnung der Regulatorgene. Schließlich hat die RNA von HIV-2 eine nur 40-60 prozentige Homologie zur HIV-1 RNA. Man geht heute davon aus, dass HIV-2 weniger pathogen ist als HIV-1. Da HIV-2 nur in einigen Regionen Westafrikas vorkommt und weltweit für weniger als 1 % aller HIV-Infektionen verantwortlich ist, soll im Folgenden hauptsächlich HIV-1 beschrieben werden.
Die Morphologie von HIV-1
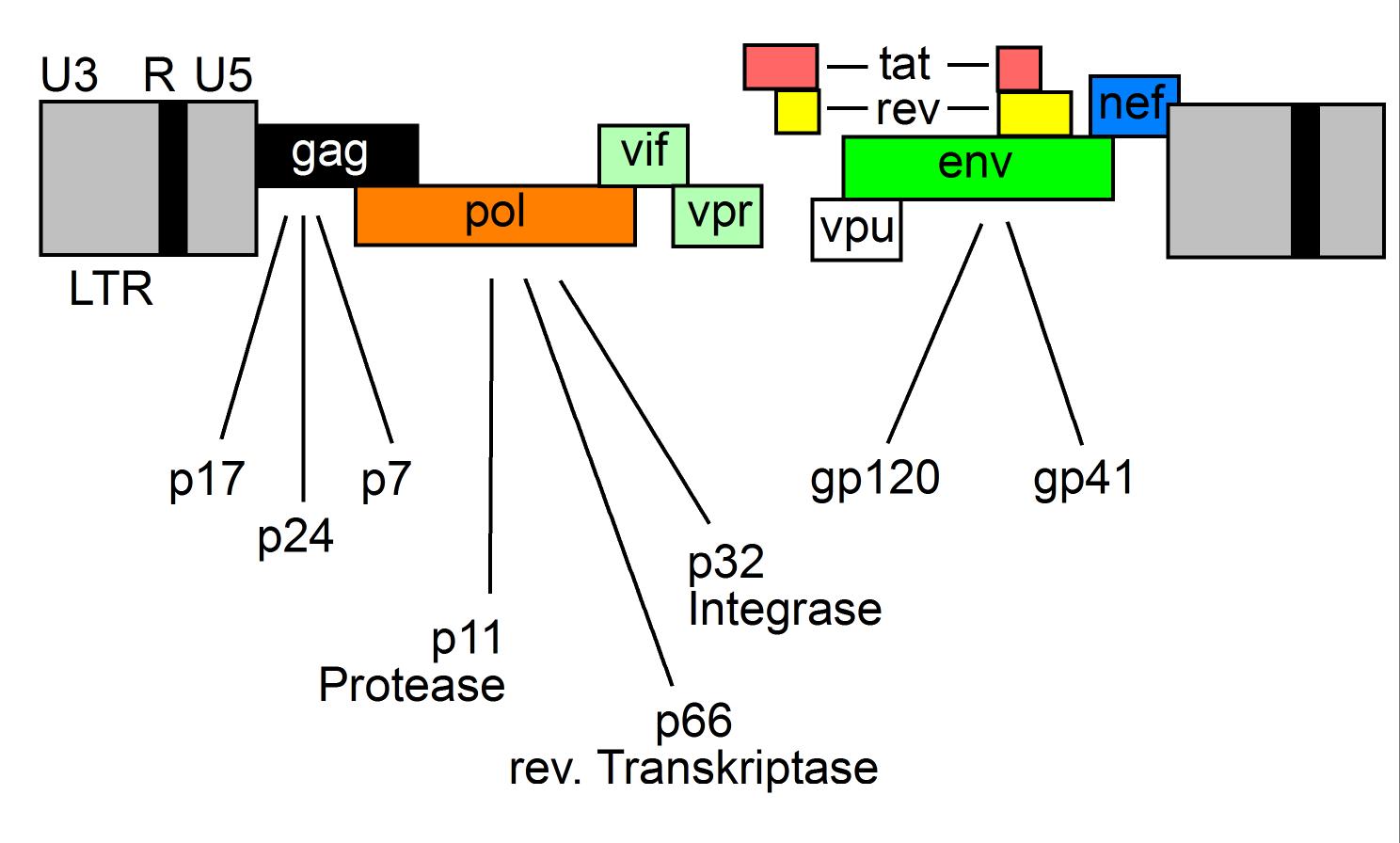
Die etwa 100 nm großen HIV-1-Viruspartikel sind von einer Lipoproteinhülle umgeben, in die insgesamt 72 etwa 10 nm große env-Glykoproteinkomplexe eingebettet sind. Diese bestehen aus einem externen Anteil (gp120) und einem Transmembranprotein (gp41). Aufgrund einer nur losen Bindung von gp120 an gp41 und der Hüllmembran kann gp120 spontan freigesetzt werden, was als „shedding” bezeichnet wird. Glykoprotein gp120/160 kann sowohl im Serum als auch im lymphatischen Gewebe HIV-infizierter Patienten nachgewiesen werden. Die Virushülle enthält außerdem verschiedene Proteine der Wirtszelle, z. B. HLA Klasse I- und II-Moleküle, die beim Abscheiden des Virus („budding”) aus der virusproduzierenden Zelle in dessen Membran inkorporiert werden, sowie Adhäsionsproteine wie ICAM-1, was das Anheften an andere Zielzellen erleichtert. Das p17-Matrixprotein ist an der Innenseite der Virushülle verankert. Das p24-Kapsid-Antigen („core antigen”) ist von zylindrischer Gestalt und enthält zwei Kopien der HIV-RNA. Diese liegt ihrerseits als Protein-Nukleinsäurekomplex, gebunden an das Nukleoprotein p7 und die reverse Transkriptase p66, vor. Außer der reversen Transkriptase (RT) enthält das Viruspartikel auch andere Enzyme, die es für seine Vermehrung benötigt: Integrase p32 und Protease p11 (Übersicht in: Gelderblom 1993) (Abb. 1).
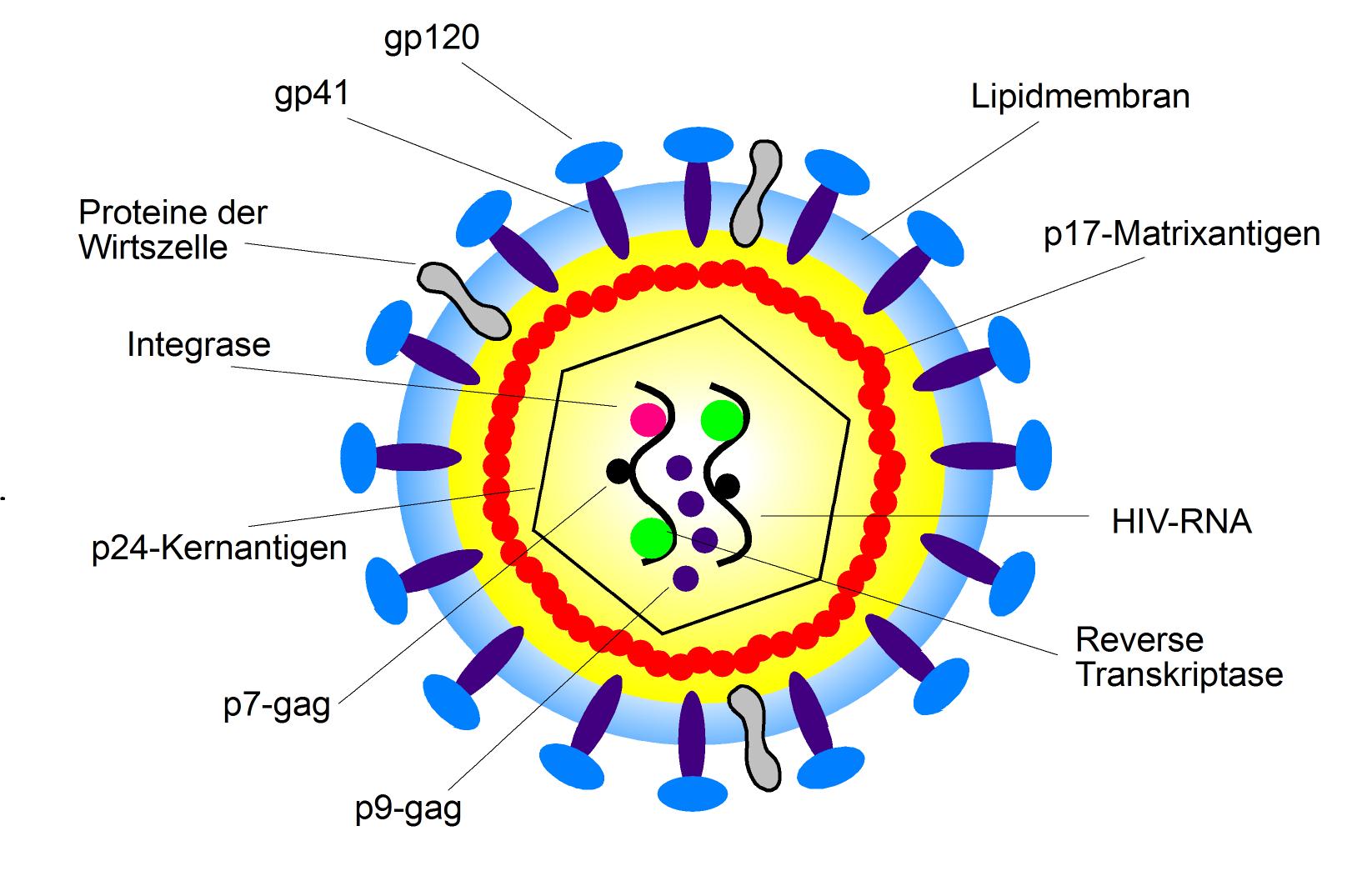
Abbildung 1: HIV und seine Gene.
Die Organisation des viralen Genoms
Die meisten replikationskompetenten Retroviren benötigen im wesentlichen die drei Gene gag, pol und env: gag bedeutet „group-antigen”, pol steht für „polymerase” und env steht für „envelope” (Übersicht: Wong-Staal 1991).
Das „klassische” Aufbauschema (siehe Abbildung 2) eines retroviralen Genoms ist: 5’LTR-gag-pol-env-LTR 3’, wobei die LTR („long terminal repeat”)‑Regionen diejenigen Teile des viralen Genoms sind, die bei der Integration beidseitig mit der zellulären DNA verbunden werden. Die Gene gag und env kodieren das Nukleokapsid und die Glykoproteine der Virushülle, das pol Gen kodiert für die RT und andere Enzyme. HIV-1 enthält in seiner ca. 9 kB-RNA jedoch sechs zusätzliche Gene (vif, vpu, vpr, tat, rev und nef). Nef, vif, vpr und vpu werden auch als akzessorische Gene bezeichnet, da sie zumindest in vitro für die Virusreplikation nicht unbedingt erforderlich sind.
Tat und rev sind regulatorische Proteine, die im Zellkern akkumulieren und an bestimmte Stellen der viralen RNA binden. Das Tat-Protein ist essentiell für die Virusreplikation in nahezu allen Kultursystemen. Cyclin T1 ist der notwendige zelluläre Kofaktor für tat (Wei 1998). Tat und rev stimulieren die Transkription von HIV-DNA in RNA und deren Elongation, fördern den Transport von HIV-RNA vom Zellkern ins Zytoplasma und sind wesentlich für die Translation. Rev, der nukleäre Exportfaktor, ist wichtig für die Umstellung der Expression früher regulatorischer Proteine zu den später synthetisierten Strukturproteinen.
Abbildung 2: Aufbau eines HIV-Virionpartikels.
Nef wird ebenso wie tat und rev als regulatorisches Protein früh während des Replikationszyklus produziert. Nef induziert eine Herabregulation von CD4 und von HLA-Klasse-I-Antigenen (Collins 1998) an der Oberfläche infizierter Zellen, was ein „Entkommen” vor dem Angriff zytotoxischer T-Zellen begünstigt. Nef beeinflusst die Aktivierung von T-Zellen, indem es mit verschiedenen Proteinen interferiert, die intrazellulär in Signaltransduktionsketten involviert sind (Übersicht in: Peter 1998). Studien an SIV-infizierten Rhesusaffen zeigen zudem, dass ein intaktes nef Gen für eine hohe Virusreplikation und die Progression der Erkrankung essentiell ist.
Vpr kann sowohl die HIV-LTR als auch eine Reihe von zellulären und viralen Promotern stimulieren und scheint für die Virusreplikation in nicht-teilenden Zellen wie z. B. Makrophagen von Bedeutung zu sein. Vpr ist für den Transport des viralen Präintegrationskomplexes zum Kern von Bedeutung (Übersicht: Miller 1997) und kann Zellen in der G2-Phase des Zellzyklus arretieren.
Vpu spielt eine Rolle beim „budding”, da bei Mutationen in vpu die Viren an der Zelloberfläche verbleiben. Offensichtlich haftet HIV an das Membranmolekül „Tetherin“ (CD317) und benutzt vpu als einen viralen Fluchtmechanismus, um vollständig aus der Zellen freigesetzt zu werden (Varthakavi 2008, Neil 2009, Kühl 2010). Dieser Mechanismus hat offenbar auch große Bedeutung für die Evolution von HIV als pandemisches Virus (Sauter 2009). Außerdem ist vpu an der Degradation von CD4-gp160-Komplexen im endoplasmatischen Retikulum beteiligt, damit genügend gp160 bei der Neubildung von Virionen bereit steht (Cullen 1998).
Vif-defiziente HIV-1 Isolate replizieren weder in primären CD4+ T-Zellen, noch in einigen T-Zell-Linien oder in Makrophagen. Intrazellulär wird die reverse Replikation zwar initiiert, jedoch keine provirale DNA synthetisiert. Weitere Experimente zeigten, dass die Fusion von „permissiven“ und „nicht-permissiven“ Zellen zu „nicht-permissiven“ Zellen führt, was nahe legt, dass die Replikation von HIV von der Anwesenheit eines inhibitorischen Faktors abhängt. Dieser Faktor wurde als APOBEC3G identifiziert (Sheehy 2002). APOBEC3G („apolipoprotein B mRNA editing enzyme, catalytic polypeptide-like 3G“) gehört zu einer Familie von intrazellulären Enzymen, die spezifisch Cytosin zu Uracil in mRNA oder viraler Einzelstrang-DNA deaminieren. Dadurch entstehen vermehrt G-zu-A-Mutationen mit Stop-Codons, deren Akkumulation zu einer Degradation der viralen DNA führt. Oft kommt es jedoch schon vorher zu einem DNA-Abbau, da Uracil durch Uracil-DNA-Glycosidase verändert und das virale Genom dann Ziel spezifischer Endonukleasen wird. Vif bildet einen Komplex mit APOBEC3G (Mariani 2003), wodurch die inhibitorische Aktivität von APOBEC3G blockiert wird (Abbildung 3a).
Abbildung 3a: Replikation von Wildtyp-HIV. In Anwesenheit von vif wird APOBEC3G neutralisiert, und es kommt zur ungestörten fortgesetzten Replikation von HIV in der Zielzelle.
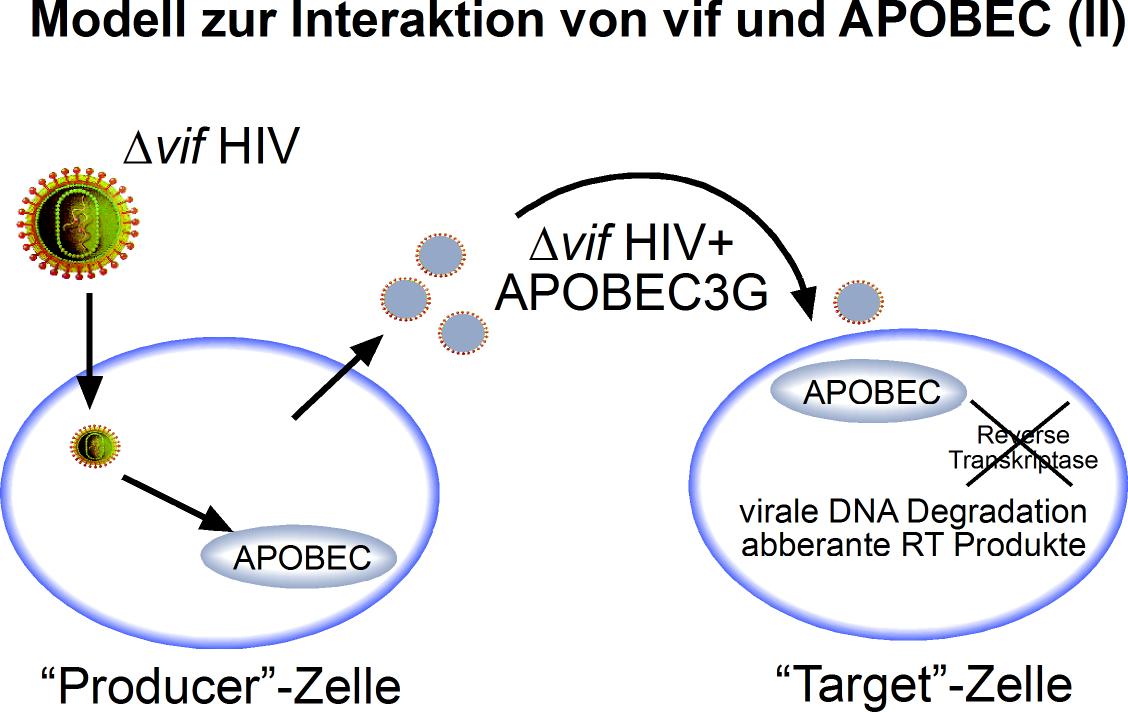
Die antivirale Aktivität von APOBEC3G zwischen verschiedenen Spezies ist hochkonserviert, die Blockade von APOBEC3G durch vif dagegen hochspezifisch für HIV. So werden APOBEC3G der Maus oder des Affen durch vif von HIV-1 nicht blockiert. In Abwesenheit von vif wird APOBEC3G in neu produzierte Virionen inkorporiert, so dass bei nachfolgender Infektion anderer Zielzellen in diesen die Synthese proviraler DNA blockiert wird (Abbildung 3b). Ist vif dagegen anwesend, wird APOBEC3G komplexiert und nicht in Virionen inkorporiert, die die Zelle verlassen.
Auch die Tatsache, dass APOBEC3G in Lymphozyten und Makrophagen, den hauptsächlichen zellulären Replikatoren von HIV, exprimiert wird, spricht für eine weitreichende Relevanz dieser Interaktion. In DC wird die Menge an APOBEC3G durch den Aktivierungszustand der Zellen reguliert: Mit der Maturation der DC steigt die Menge an APOBEC3G (Pion 2006). Unklar ist noch, ob es eine kritische Menge an APOBEC3G intrazellulär gibt, die die Zellen trotz vif resistent gegenüber einer HIV-Infektion macht, oder ob genetische Polymorphismen die Expression von APOBEC und somit potentiell den Verlauf der HIV-Infektion beeinflussen können. Experimentelle Daten zeigen, dass der Aktivitätszustand der Lymphozyten entscheidend die enzymatische Funktion von APOBEC3G beeinflusst (Chiu 2005). Die Bindungsstellen von vif an APOBEC3G sowie die katalytische Domäne wurden inzwischen charakterisiert und der intrazelluläre Abbauweg von APOBEC3G über proteasomale Degradation untersucht. Die Suche nach spezifischen Inhibitoren, die entweder die Inaktivierung von APOBEC3G durch vif oder aber die intrazelluläre Degradation von APOBEC3G inhibieren könnten, hat begonnen und könnte einen neuen attraktiven antiretroviralen Therapieansatz darstellen. Der entscheidende Vorteil: Werden zelluläre Strukturen anstatt viraler Proteine therapeutisch blockiert, ist das Risiko, dass sich Resistenzen ausbilden, wahrscheinlich gering.
Abbildung 3b: Replikation von vif-defekten HIV-Isolaten. Es kommt zur Infektion der primären Zelle; da aber vif fehlt, wird APOBEC3G in die sich bildenden Virionen inkorporiert und hemmt die reverse Transkription in den nachfolgenden Zielzellen.
Der Replikationszyklus von HIV
Der Eintritt von HIV in seine Zielzelle
CD4 als primärer Rezeptor für HIV: CD4 ist ein 58 kDa schweres monomeres Glykoprotein und befindet sich auf der Oberfläche von ca. 60 % aller T-Lymphozyten, von T-Zellvorläuferzellen in Knochenmark und Thymus, auf Monozyten und Makrophagen, Eosinophilen, dendritischen Zellen und Mikrogliazellen des ZNS. Vier extrazelluläre, immunglobulin-ähnliche Bereiche von CD4 (D1-D4) wurden charakterisiert, die eine doppelte ß-Faltblattstruktur zeigen und deren
Kristallstruktur mittlerweile aufgeklärt ist.
CD4 wurde bereits 1984 als primärer und für den Viruseintritt notwendiger Rezeptor von HIV-1, HIV-2 und SIV identifiziert (Dalgleish 1984, Klatzmann 1984). Einige wenige Laborisolate von HIV-1 und HIV-2 können auch CD4-unabhängig Zellen infizieren. Residuen in der V2-Region von CD4 sind für die Bindung von gp120 an CD4 wesentlich. Dieser Bereich überlappt den Bereich von CD4, an den seine natürlichen Liganden, HLA-Klasse II-Moleküle, binden. Die Identifikation der Bindungsstelle von HIV-1-gp120 an CD4 der T-Helferzelle führte zu Therapie-versuchen mit löslichem („soluble”) sCD4 (Schooley 1990), die jedoch erfolglos verliefen. Besser wirksam war Pro-542, ein tetravalentes CD4-IgG2 Fusionsprotein, das in ersten klinischen Studien zu einer signifikanten Hemmung der Virusreplikation geführt hat, inzwischen aber nicht weiter verfolgt wird (Olson 2003).
Auf CD4+ T-Zellen gehört CD4 zum T-Zellrezeptor (TCR) TCR/CD3 Komplex und kann an HLA-Klasse II-Moleküle auf der Oberfläche von antigenpräsentierenden Zellen binden. Die Bindung von gp120 an CD4 ist nicht nur ein wesentlicher Schritt bei der Infektion CD4+ T-Zellen, sondern interferiert mit intrazellulären Signaltransduktionswegen und hat einen apoptosefördernden Effekt auf T-Zellen (Banda 1992).
Antikörper gegen CD4-induzierte konformationelle (CD4i) Epitope von gp120 binden interessanterweise gut an das gp120 von CD4-unabhängigen Viren. Dies legt nahe, dass bei CD4-unabhängigen Viren der Bereich von gp120, an den der Korezeptor bindet, bereits exponiert ist und nicht mehr der Induktion durch vorherige Bindung an CD4 bedarf. Derartige Viren sind besonders leicht durch Antikörper im Serum HIV-infizierter Patienten neutralisierbar, was vermuten lässt, dass die Immunantwort gegen CD4-unabhängige Viren selektiert (Edwards 2001).
Chemokinrezeptoren als Korezeptoren: Experimente, bei denen nicht-humane Zelllinien mit humanem CD4 transfiziert wurden, zeigten, dass die Expression von humanem CD4 auf der Zelloberfläche für einen erfolgreichen Viruseintritt nicht ausreicht. Die Entdeckung, dass Chemokinrezeptoren als Korezeptoren für den Eintritt von HIV in die Zelle fungieren, resultierte ursprünglich aus den Bemühungen, einen löslichen CD8-Suppressorfaktor zu charakterisieren. CD8+ T-Zellen HIV-infizierter Patienten können einerseits als zytotoxische T-Zellen (CTL) virusinfizierte Zellen erkennen und eliminieren, andererseits lösliche Faktoren sezernieren, die die Replikation von HIV hemmen (Levy 1996). Cocchi beobachtete 1995, dass die Chemokine MIP-1α, MIP-1β und Rantes die Replikation bestimmter, jedoch nicht aller Virusisolate hemmen und von CD8+ T-Zellen sezerniert werden. Wenige Monate später identifizierten mehrere Arbeitsgruppen nahezu zeitgleich CCR5 als notwendigen Korezeptor monozytotroper (M-troper) HIV-Isolate (Deng 1996, Doranz 1996, Dragic 1996). Der Chemokinrezeptor CXCR4 (Fusin) wurde zuvor als Korezeptor T-zelltroper (T-troper) HIV-Isolate charakterisiert (Feng 1996). SDF-1 („stromal cell-derived factor 1”), welcher noch im gleichen Jahr als Ligand von CXCR4 identifiziert wurde, kann den Eintritt T-troper HIV-Isolate in aktivierte T-Zellen verhindern. Rantes („regulated upon activation T cell expressed and secreted”), MIP-1α („macrophage inhibitory protein”) und MIP-1ß sind die natürlichen Liganden von CCR5 und hemmen den Viruseintritt M-troper HIV-Isolate in T-Zellen. Auch an Integrine kann HIV binden (Integrin α4β7), damit die Infektion von HIV zwischen CD4-Zellen begünstigen und deren Funktion und Migration beeinflussen (Arthos 2008).
Somit ergibt sich folgendes Modell (Abbildung 4): T-trope HIV-Isolate, die vorwiegend aktivierte PBMC und Zelllinien infizieren, benutzen CXCR4 für den Eintritt in die CD4+-positive Zielzelle. M-trope Isolate, die sowohl PBMC wie auch Monozyten und Makrophagen produktiv infizieren können, benötigen dagegen CCR5 zusätzlich zu CD4. Vereinfacht erklärt man sich die Interaktion der Virushüllproteine und der zellulären Rezeptoren damit, dass gp120 zunächst an bestimmte Bereiche von CD4 bindet. Diese Bindung an CD4 induziert konformationelle Änderungen in gp120, die dann eine Interaktion der V3 Schleife von gp120 mit dem jeweiligen Chemokinrezeptor ermöglicht, die ihrerseits Voraussetzung für die nachfolgende Membranfusion ist. Gp41, der transmembrane Anteil des Virushüllproteins gp160, spielt bei der Fusion der Virus- mit der Wirtszellmembran eine zentrale Rolle. In Analogie mit dem Influenzahämagglutinin wurde postuliert, dass nach Bindung von gp160 an CD4 auch die Ektodomäne von gp41 eine Konformationsänderung erfährt, die deshalb oft mit einer „Schnappfeder” oder „Mausefalle” verglichen wird. Dabei kommt es zu einer Insertion des hydrophoben gp41-NH2-terminalen Endes in die Membran der Zielzelle.
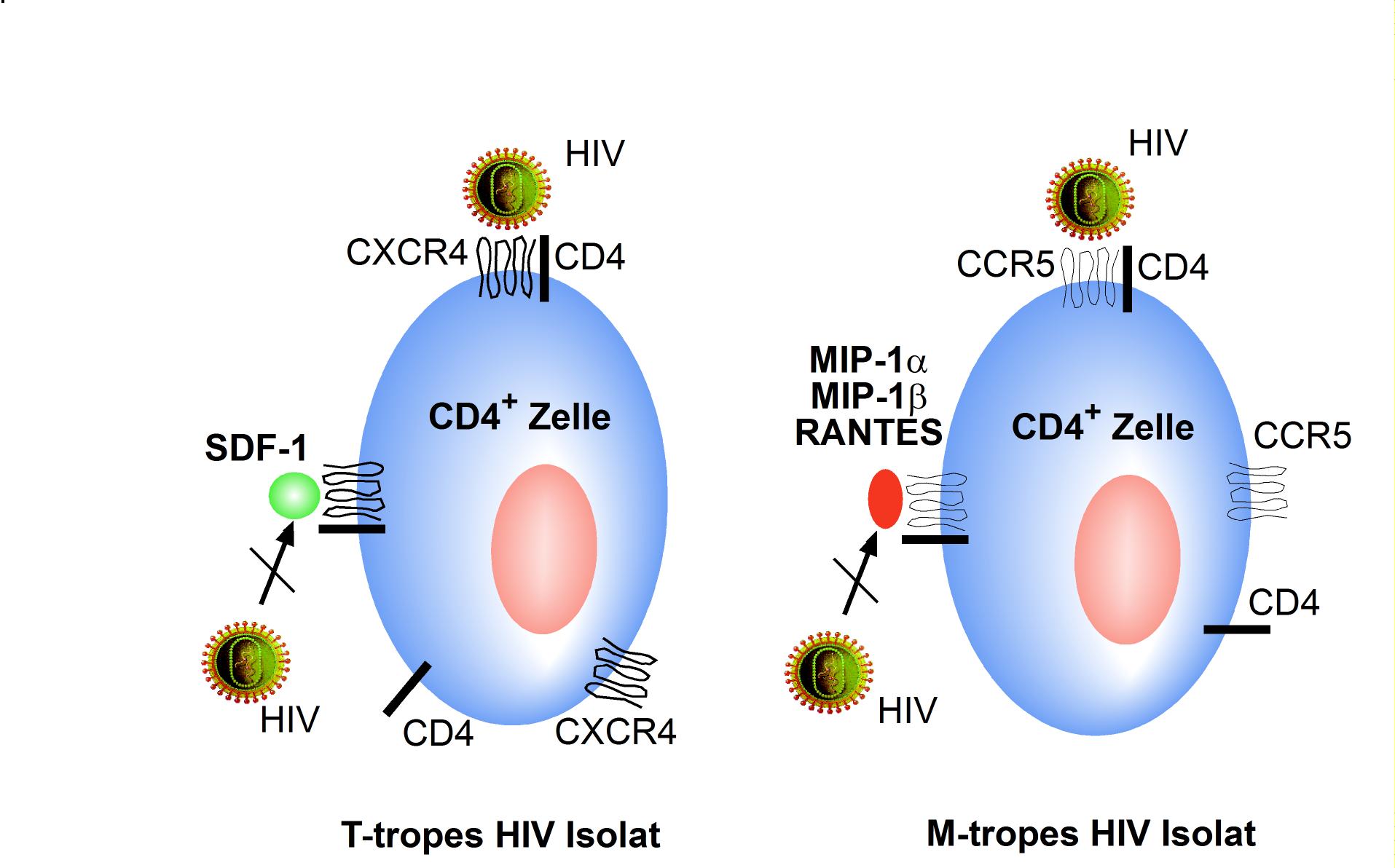
Abbildung 4: Hemmung des Viruseintritts CXCR4-gebrauchender (T-zelltroper) und CCR5-gebrauchender (monozytotroper) HIV-Isolate durch die natürlichen Liganden der Chemokin-Korezeptoren CCR5 und CXCR4
Die kristallografische Analyse der Struktur der Ektodomäne von gp41 bestätigt dies (Chan 1997). Nach Aufdeckung der für diesen Prozess wichtigen Aminosäuresequenzen wurden synthetische Peptide wie T-20 (siehe Antiretrovirale Therapie) konstruiert, die an gp41 in diesen Bereichen binden und seine konformationelle Veränderung – und somit die Membranfusion von Virus und Zielzelle – hemmen. Neuere Peptide, die aus körpereigenen Substanzen identifiziert und optimiert werden konnten und den Viruseintritt verhindern, sind ebenfalls in Machbarkeitsstudien erfolgreich erprobt worden (Forssmann 2010).
Obgleich offenbar zahlreiche weitere Korezeptoren existieren, scheinen in vivo CCR5 und CXCR4 die prädominanten Korezeptoren für M- bzw. T-trope HIV-Isolate zu sein. Die Bedeutung von CCR5 wird auch dadurch deutlich, dass Individuen mit einem genetischen Defekt des CCR5 gegenüber HIV weitgehend resistent sind (Liu 1996). In vitro zeigen sich Lymphozyten dieser Individuen resistent gegenüber einer Infektion mit M-tropen, nicht aber T-tropen Viren. Als genetische Variante des CCR5 wurde eine Deletion von 32 Basenpaaren innerhalb des Rezeptorgens identifiziert. Diese genetische Variante führt zu einem „verstümmelten” Rezeptor, der nicht an der Zelloberfläche exprimiert wird. Bislang wurden nur wenige Menschen identifiziert, bei denen es trotz dieses genetischen Defekts zu einer HIV-Infektion kam. Bei den Virusisolaten dieser Patienten handelte es sich erwartungsgemäß stets um T-trope Viren. Die Frequenz homozygoter Genträger dieser Deletion in einer kaukasischen Population beträgt ca. 1 %, die der heterozygoten Genträger ca. 20 % (Dean 1996). In afrikanischen oder asiatischen Kohorten wurde die Deletion dagegen bislang nicht gefunden.
Heterozygote Merkmalsträger zeigen in vitro eine verminderte Expression von CCR5 auf der Zelloberfläche. Diese verminderte Expression bedingt nicht nur eine verminderte Transmissionsrate von HIV. Ist es zu einer HIV-Infektion gekommen, zeigen für CCR5 heterozygote Merkmalsträger eine verlangsamte Progression zu AIDS, ein besseres Ansprechen auf ART sowie eine verminderte Lymphominzidenz. Sie zählen somit oft zu den Langzeitüberlebenden, den so genannten Long-Term-Non-Progressors (Dean 1996). Interessanterweise liegt die Expression von CCR5 bei heterozygoten Merkmalsträgern nicht wie erwartet bei 50 % der Wildtypindividuen, sondern bei lediglich 25-30 %.
Neben der CCR5-Deletion wurden noch andere Polymorphismen von CCR5, seines Promoters sowie Mutationen anderer Chemokine bzw. Chemokinrezeptoren beschrieben. Große Kohortenstudien zeigten, dass auch diese Polymorphismen den Verlauf der HIV-Infektion akzelerieren oder verlangsamen können (Anzala 1998, Winkler 1998) und einen Einfluss auf das immunologische Ansprechen der HIV-Therapie und die zelluläre Immunität besitzen (Dolan 2007, Ahuja 2008).
Patienten mit einem rapid progressivem Verlauf scheinen eher Isolate zu haben, die CXCR4 als Korezeptor benutzen (T-trope Isolate). In der Frühphase der HIV-Erkrankung finden sich dagegen meist M-trope Virusisolate. Die Expression von Korezeptoren hängt außerdem vom Aktivierungszustand der CD4+ T-Zellen ab. So findet sich CXCR4 insbesondere auf naiven T-Zellen, CCR5 hingegen auf aktivierten bzw. auf Effektor/memory T-Zellen. Bei der Transmission von HIV werden vornehmlich M-trope Isolate weitergegeben, auch wenn im „Donor” T-trope Isolate überwiegen. Ob dieser „in vivo” Tropismus durch dendritische Zellen bedingt wird, die das Virus zum regionalen lymphatischen Gewebe transportieren, oder ob das lokale Zytokin-/Chemokinmilieu anfänglich die Replikation M-troper Isolate favorisiert, ist noch in der Diskussion.
Synthetische CCR5-Liganden (insbesondere RANTES-Analoga) zur Blockade von CCR5, so genannte CCR5-Antagonisten, haben ihren Einzug in die HIV-Therapie gefunden oder befinden sich in klinischen Studien (siehe Antiretrovirale Therapie). CCR5-Inhibitoren wurden im Affenmodell auch erfolgreich als Mikrobizide eingesetzt und könnten eine präventive Option darstellen (Veazey 2005). Auch monoklonale Antikörper gegen CCR5 (z. B. 2D7) können den Eintritt M-troper Viren in T-Zellen und Makrophagen hemmen. Allerdings legen in-vitro-Untersuchungen und auch in-vivo-Untersuchungen an SCID-Mäusen nahe, dass Viren unter einer CCR5-Blockade Viren ihren Tropismus hin zu CXCR4 ändern können. Andere kleine Moleküle wie T-22, ALX40-4C, AMD 3100 oder AMD 070 inhibieren CXCR4 (De Clercq 2001), einige werden derzeit ebenfalls klinisch getestet.
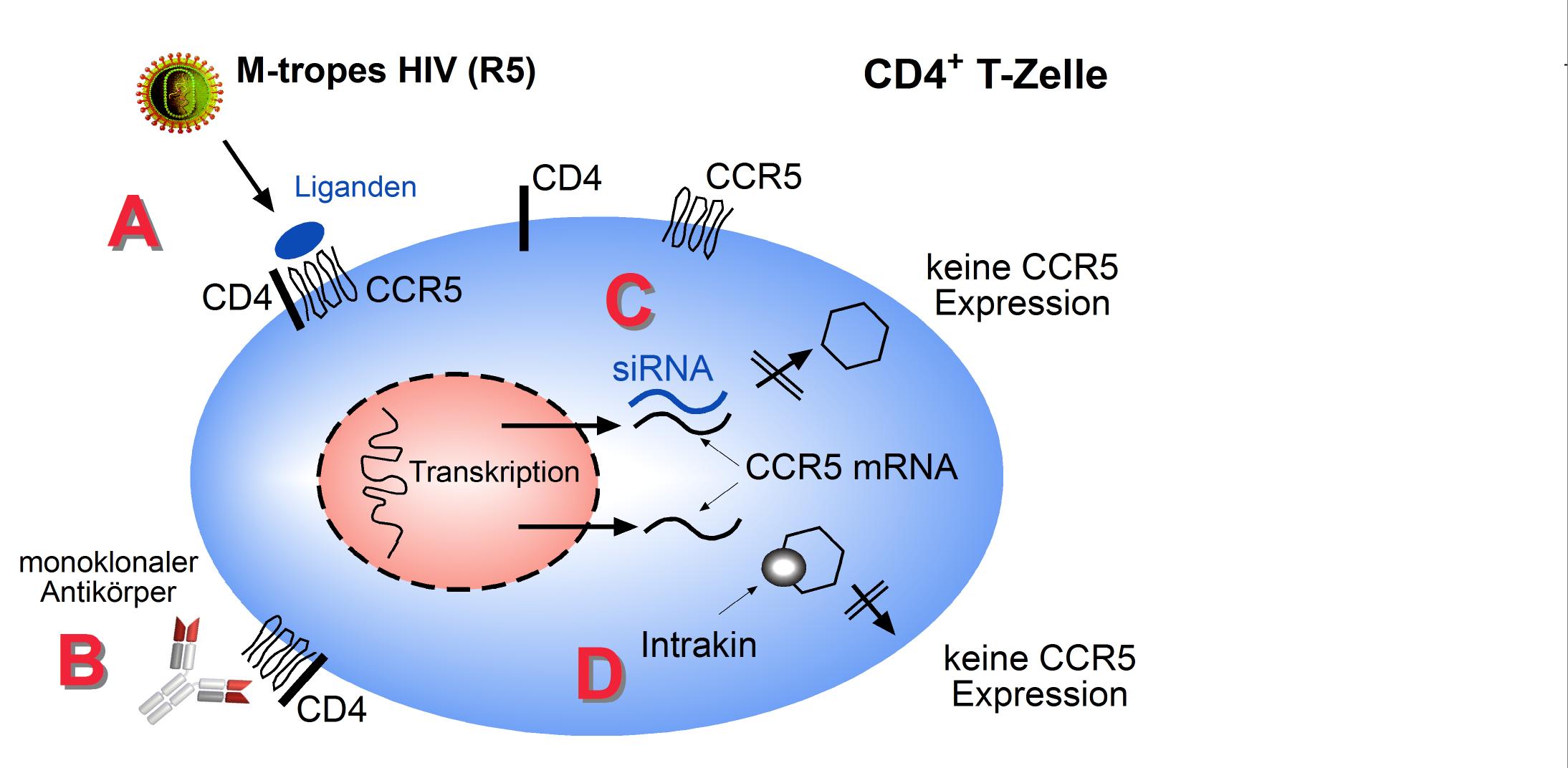
Daneben werden Strategien untersucht, die Expression von Chemokinrezeptoren gentherapeutisch zu modulieren. Intrakine sind Chemokine, die intrazellulär verbleiben und den jeweils passenden Chemokinrezeptor auf seinem Weg an die Zelloberfläche intrazellulär festhalten können (Chen 1997). Eine neuartige Strategie ist der Einsatz von siRNA („short interfering RNA“). Doppelsträngige RNA wird durch das Enzym Dicer-1 in kurze Bruchstücke („21-23mere“) gespalten. Diese können dann an längere RNA komplementär binden, die schließlich degradiert wird. Theoretisch ist aber auch hierbei eine Resistenzentwicklung möglich. Der Einsatz von siRNA gegen CCR5 kann in vitro selektiv die Expression von CCR5 hemmen (Abbildung 5).
Abbildung 5: Möglichkeiten einer Blockade von Infektionen mit CCR5-tropen Virusisolaten: Blockade des CCR5 an der Zelloberfläche durch nicht-agonistische Liganden (A) oder monoklonale Antikörper (B). Der Einsatz von siRNA (C) oder Intrakinen (D) kann die Expression des CCR5 an der Zelloberfläche verhindern.
Hinsichtlich der therapeutischen Blockade von Chemokinrezeptoren sind jedoch noch viele Fragen offen. Chemokinanaloga wie AOP-Rantes können theoretisch auch an andere Chemokinrezeptoren und nicht nur an CCR5 binden. Im Maussystem konnte gezeigt werden, dass das Fehlen von SDF-1 oder CXCR4 mit schweren Entwicklungsstörungen von Herz, ZNS und Blutbildung assoziiert war (Zou 1998). Unklar ist jedoch, ob SDF-1 bzw. CXCR4 auch nach der fetalen Entwicklung eine derartig essentielle Bedeutung für den Organismus haben.
Die Vorgänge nach dem Viruseintritt
Nach der Membranfusion entleert sich der Viruskern in das Zytoplasma („Uncoating“). Aber auch rezeptorvermittelte Endozytose und dynaminabhängige Fusion mit intrazellulären Kompartimenten (Miyauchi 2009) spielen bei der Virusaufnahme eine Rolle. HIV kann auch in Affen-Lymphozyten eindringen, wird aber vor bzw. während der frühen reversen Transkription gestoppt. Diese intrazelluläre Resistenz wird durch TRIM5αrh vermittelt, wobei die Replikation von HIV durch Rhesus-TRIM5α stärker gehemmt wird als durch humanes TRIM5α (Stremlau 2004). Humanes und auch TRIM5α nicht-humaner Primaten können die Replikation auch anderer Lentiviren hemmen und scheinen somit ein zellulärer antiviraler Resistenzfaktor zu sein, deren vollständige Bedeutung aktuell noch gar nicht erfasst werden kann. Unklar ist der genaue Wirkungsmechanismus, wie TRIM5α mit der frühen reversen Transkription von Retroviren interagiert. Möglicherweise interferiert TRIM5α mit dem „Uncoating“, also der Freisetzung viraler RNA ins Zytoplasma der Zielzelle, dient aber auch als Erkennungsmechanismus für die Zelle und der Aktivierung der unspezifischen Immunantwort (Pertel 2011).
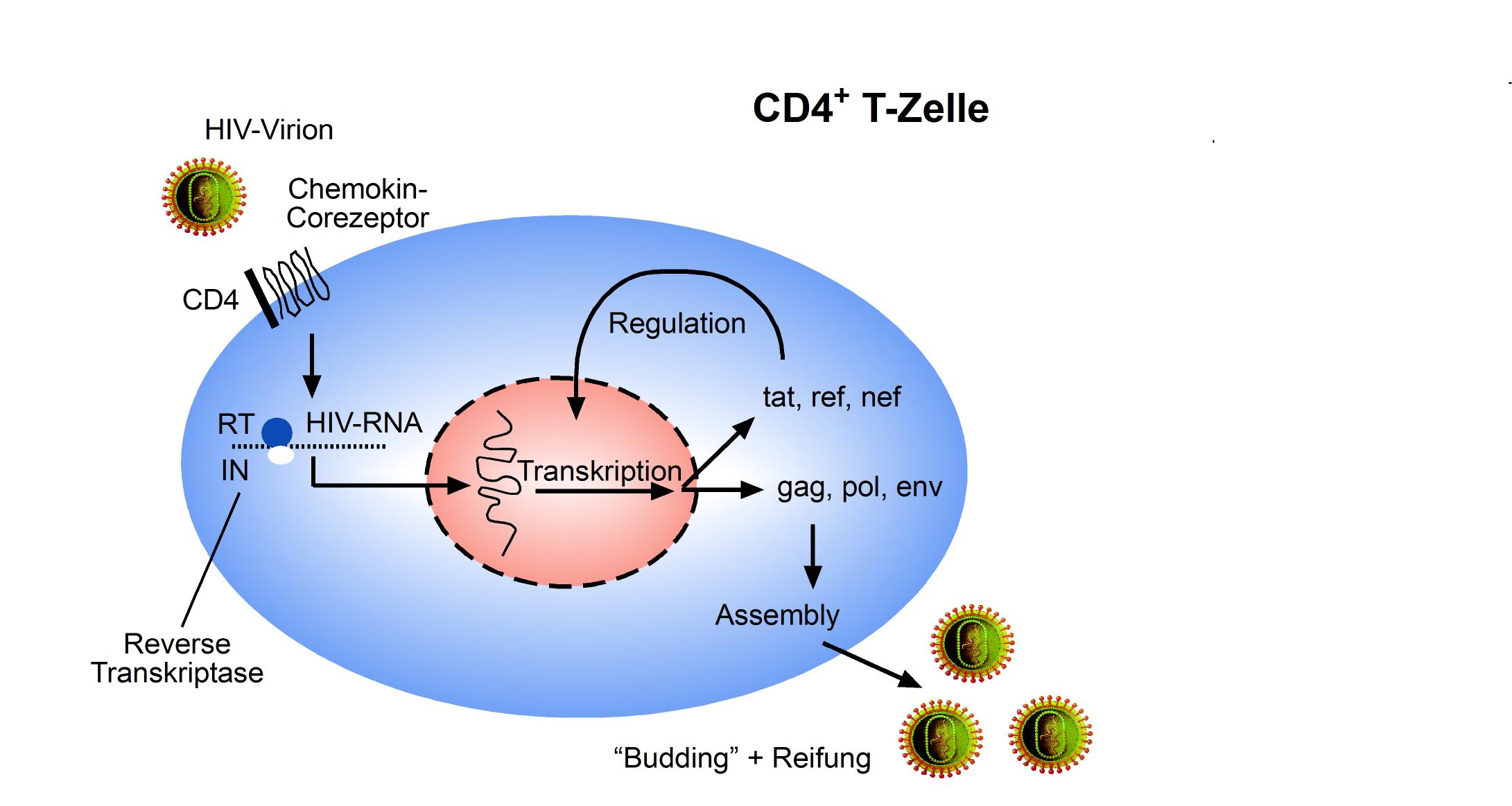
Der Eintritt von HIV-1 in ruhende T-Zellen ist vergleichbar mit dem Eintritt in aktivierte T-Zellen. Allerdings wird in ruhenden T-Zellen nur eine inkomplette DNA-Spezies synthetisiert (Zack 1990). Die Umwandlung von viraler RNA in provirale DNA im Zytoplasma der CD4+ T-Zelle mittels der RT ist ein kritischer Schritt im Lebenszyklus des Virus (Abbildung 6).
Abbildung 6: Lebenszyklus von HIV innerhalb einer Zielzelle (CD4+ T-Zelle)
HIV und das ImmunsystemDie Bedeutung antigenpräsentierender Zellen
Dendritische Zellen
Antigenpräsentierende Zellen, zu denen dendritische Zellen, Makrophagen und B-Lymphozyten gerechnet werden, bilden das „immunologische Fenster” zur Außenwelt. Dendritische Zellen (DC) gehören zu den potentesten Induktoren einer adaptiven Immunantwort. Vorläufer der DC wandern aus dem Knochenmark in periphere Gewebe und primäre lymphatische Organe, können dort lösliche und zelluläre Antigene aufnehmen und prozessieren und migrieren zu den sekundären lymphatischen Organen, wo sie antigenspezifische T-Zellen aktivieren. Aufgrund ihrer zentralen Rolle in der adaptiven Immunantwort gegen HIV sind sie Zielstrukturen für Vakzinestrategien, die HIV-spezifische T-Lymphozyten induzieren oder expandieren sollten. Alternativ wurden DC von Patienten direkt aufgereinigt, mit inaktiviertem, nicht-infektiösem HIV inkubiert und zur Vakzinierung verabreicht (Lu 2004).
DC sind eine heterogene Familie von Zellen. Sowohl die funktionellen Eigenschaften als auch die Expression phänotypischer Marker hängen vom Mikroenvironment und dem jeweiligen Reifungsstadium ab. Unreife DC monozytären Ursprungs (MDDC) können vor allem Fremdantigen aufnehmen und prozessieren, zeigen aber nur eine geringe T-zellstimulatorische Aktivität. Reife MDDC zeichnen sich dagegen durch eine ausgeprägte immunstimulatorische Kompetenz über die Expression kostimulatorischer Moleküle aus. Gewebeständige DC und Langerhans-Zellen entsprechen einem unreifen Phänotyp; während der Migration zum Parakortex sekundärer lymphatischer Organe reifen sie aus. Plasmazytoide DC haben die Eigenschaft, bei Virusinfektionen nach Stimulation von Toll-like Rezeptoren (TLR) große Mengen von antiviral wirksamen IFN-α zu produzieren (Beignon 2005). Sie sind damit eine Verbindung zwischen unspezifischem und adaptivem Immunsystem.
Die Stimulation von CD8+ T-Lymphozyten und Ausbildung von zytotoxischen T-Zellen (CTL) gelingt nach Präsentation eines antigenen Peptids im Zusammenhang mit HLA-Klasse I Antigen. Werden DC mit Viren (z. B. Influenza) infiziert, so benutzen die Viren die zelleigene „Maschinerie”, um virale Proteine zu synthetisieren, die ebenso wie zelleigene Proteine durch Proteasomen in Peptide degradiert werden. Diese Peptide werden dann vom Zytosol ins endoplasmatische Retikulum transloziert und dort an HLA‑Klasse I‑Moleküle gebunden. Die resultierenden Peptid-HLA-Klasse-I-Komplexe wandern dann an die Zelloberfläche. Daneben wurde jedoch experimentell auch gezeigt, dass DC die Antigene nicht-replizierender Viren ebenso effektiv präsentieren können, wie wenn sie selber infiziert sind (Lu 2004). DC sind aber offenbar relativ resistent gegenüber einer Infektion mit HIV, und intrazellulär Erkennungsstrukturen tragen dazu bei, dass nach Eintritt von HIV unspezifische Immunabwehrmechanismen aktiviert werden (Manel 2011). Daneben können DC auch Antigene von absterbenden Zellen oder immunkomplexiertes Virus via HLA–Klasse I präsentieren. Die Präsentation exogener Antigene via HLA-Klasse I-Moleküle („cross-presentation“) spielt bei der HIV-Infektion für die Entwicklung von CTL eine Rolle (Larsson 2002, Maranon 2004).
Die Interaktion von dendritischen Zellen und B/T-Zellen
B- und T-Lymphozyten gelten als Effektoren der Immunantwort. Ihre Funktion wird von DC kontrolliert. DC können in der Peripherie Antigen aufnehmen und prozessieren. Sie exprimieren zudem Moleküle, die Lymphozyten aktivieren und migrieren zu den lymphatischen Organen. B-Zellen erkennen Antigen direkt durch Bindung an den B-Zellrezeptor, T-Zellen erst nach Prozessierung und Präsentation durch die DC. Die intrazelluläre Halbwertzeit der Peptide beeinflusst die Immunreaktion durch CD8+ T-Zellen (Lazaro 2011). Die T-Zellrezeptoren erkennen Fragmente von Antigen, die im Kontext mit HLA-Klasse I- bzw. II-Molekülen CD8+– bzw. CD4+ T-Zellen stimulieren. Die Fähigkeit von DC, autologe und allogene T-Zellen zu stimulieren, beruht sowohl auf zellulären Faktoren als auch auf der Sekretion von Zytokinen (z.B. IL-12).
DC haben eine enorme immunstimulatorische Potenz: nur wenige DC und eine geringe Menge Antigen reichen aus, um eine potente T-Zellantwort zu induzieren. Die Expression von Adhäsionsmolekülen und Lektinen wie DC-SIGN (Cell 2000) oder Mannoserezeptor (CD206) fördert die Aggregation von DC mit T-Zellen, das Engagement des T-Zellrezeptors, die wechselseitige Infektion zwischen den Zellen und damit die Verbreitung des Virus im Körper (Gringhuis 2010). DC-SIGN ist ein Typ C-Lektin und bindet Lentiviren wie HIV oder SIV über eine Interaktion von gp120 mit Karbohydraten. DC-SIGN ist in vivo nicht auf Langerhans-Zellen, sondern auf submukosalen und dermalen DC exprimiert. Das lässt vermuten, dass DC-SIGN neben CD4 und CCR5 bei der vertikalen und mukosalen Transmission von HIV bedeutsam ist.
Das lymphatische Gewebe als Ort der Virusreplikation
Im mukosa-assoziierten lymphatischen Gewebe befinden sich die meisten CD4+ T-Zellen, von denen viele CCR5 exprimieren und als so genannte Gedächtniszellen (memory cells) eingeordnet werden. Eine Reihe wichtiger Studien (Mehandru 2004, Mattapallil 2005, Li 2005) hat gezeigt, dass eine zentrale Eigenschaft der SIV- und HIV-Infektion die massive Infektion und Depletion dieser CD4+CCR5+ memory T-Zellen ist. Dabei stammen in 80 % der infizierten Personen die Virusnachkommen von nur einem einzigen HI-Virus ab, welches die Infektion verursacht hat, wie die Einzelgenomanalysen viraler RNA von Patienten mit akuter HIV-Infektion gezeigt haben (Keele 2008). In der Frühphase der SIV-Infektion können am Gipfel der Virusreplikation bis zu 60 % der CD4+ T-Zellen in der intestinalen Lamina propria Virus-RNA enthalten. Die meisten dieser Zellen sind bereits wenige Tage später durch direkte und indirekte Zerstörung endgültig verloren. Die weitere Krankheitsprogression hängt offensichtlich von der Fähigkeit des Immunsystems ab, den Pool dieser Memory CD4+ T-Lymphozyten im mukosa-assoziierten lymphatischen Gewebe wieder herzustellen (Picker 2004). Einige Forscher befürworten daher einen sofortigen ART-Beginn im Rahmen einer akuten HIV-Infektion, um den Schaden am Immunsystem zu begrenzen.
Bereits in der Frühphase der HIV-Infektion findet eine ausgeprägte Virusreplikation auch in anderen Bereichen des lymphatischen Gewebes und im hämatopoetischen System statt (Embretson 1993, Pantaleo 1993, Carter 2010). Es entwickelt sich gleichzeitig eine HIV-spezifische Immunantwort, die die initial ausgeprägte Plasmavirämie einzudämmen vermag. Virionen werden dabei im Bereich des Netzwerkes der follikulär dendritischen Zellen (FDC) des lymphatischen Gewebes in Form von Immunkomplexen festgehalten; Makrophagen und latent infizierte CD4+ T-Zellen etablieren sich früh als permanentes Virusreservoir und können potentiell weitere Zellen infizieren. Im gesamten Verlauf der HIV-Infektion findet die Virusreplikation vorwiegend im lymphatischen Gewebe statt. Die Frequenz von Zellen mit proviraler DNA ist im lymphatischen Gewebe ca. 5‑10 x höher als in mononukleären Zellen des peripheren Blutes, die Unterschiede in der Virusreplikation sind 10‑100-fach. Während in der Frühphase der Infektion die großen Virusmengen zumeist aus aktivierten T-Zellen und Makrophagen stammen, resultieren die niedrigeren Viruskonzentrationen später eher aus ruhenden T-Zellen, dendritischen Zellen und FDC.
Erst die Aktivierung der CD4+ T-Zelle nach Eintritt von HIV ermöglicht die Integration der proviralen DNA, was die Voraussetzung für die Synthese neuer Virionen ist. In vitro Untersuchungen zeigen zudem, das HIV-1 sich bevorzugt in aktive Gene (so genannte „hot spots“) integriert (Schroder 2002). In dieser Hinsicht bietet das Mikromilieu des lymphatischen Gewebes ideale Bedingungen für die Replikation von HIV. Der enge räumliche Kontakt zwischen antigenpräsentierenden Zellen und CD4+ T-Zellen, die Anwesenheit infektiöser Virionen im Bereich der FDC und das Vorhandensein vieler proinflammatorischer Zytokine wie TNFα oder IL-6 (Stacey 2009) begünstigen die Induktion einer Virusreplikation in latent infizierten Zellen und verstärkt das Ausmaß der Virusvermehrung in bereits infizierten Zellen. Zudem kommt es durch den Übertritt von mikrobiellen Produkten aus dem Darm zu einer systemischen Immunaktivierung (Brenchley 2006, Klatt 2010), wodurch wieder CD4+ T-Zellen verloren gehen (Ciccone 2010) und die Progression der Erkrankung vorangetrieben wird (Estes 2010).
Die Bedeutung einer antigenbedingten Aktivierung von CD4+ T-Zellen wird durch in vitro und in vivo Studien unterstrichen, die einen Anstieg der HIV-Replikation nach Stimulation mit Antigenen wie Tetanustoxoid, Influenza oder im Rahmen einer Infektion mit Mycobacterium tuberculosis aufzeigen konnten (O’Brian 1995). Dies soll kein Argument gegen Impfungen sein, unterstreicht aber, dass jede Situation, in der das Immunsystem aktiviert wird, potentiell mit einem Anstieg der Virusreplikation einhergeht (siehe dazu auch Impfungen).
Die chronische Phase der HIV-Infektion dauert meist Jahre. Charakteristisch sind ein langsamer, kontinuierlicher Abfall der CD4+ T-Helferzellzahlen im peripheren Blut, eine weitgehend konstante Zahl infizierter CD4+ T-Lymphozyten und erhöhten Apoptoseraten von CD4+ und CD8+ T-Zellen. Besonders die vermehrte Apoptose wird als Ausdruck einer chronischen, generalisierten Immunaktivierung und als ursächlich für den späteren Abfall der Helferzellen angesehen. Selbst eine effektive HIV-Therapie kann diese Effekte nicht vollständig unterbinden (Sauce 2011). Diese Immunaktivierung (durch HIV und opportunistische Infektionen) bietet neues Substrat für HIV und virusinduzierten Zelluntergang (Lore 2005), konsumiert den Pool naiver und ruhender Gedächtniszellen bei gleichzeitiger Expansion kurzlebiger Effektor T-Helferzellen und führt zu Störungen im Zellzyklus mit vermehrter aktivierungsinduzierter Apoptose (Derdeyn 2005). Helferzellen, sind offensichtlich besonders anfällig für diese Schädigungen und der Transkriptionsfaktor FOXO3a hat bei der Regulation der Apoptoserate von Gedächtnis-Helferzellen offenbar ein besondere Rolle, wie Untersuchungen an HIV-Patienten mit wenig progredientem Infektionsverlauf zeigen (van Grevenynghe 2008). HIV kann infizierte Zellen direkt durch seine Hüllenproteine (Env) oder durch Caspaseaktivierung (Vpr) zerstören oder durch indirekte Effekte (z.B. Fas-FasLigand) zwischen infizierten und nicht-infizierten Zellen Apopotose induzieren. In einigen Affen führt die Infektion mit SIV nicht zu einer Immundefizienz, da Nef in diesen Tieren die Expression von CD3 sowie des T-Zellrezeptors herabreguliert und darüber die T-Zellaktivierung und den Zelluntergang inhibiert. Im Menschen hat Nef diese Fähigkeit offensichtlich verloren, was daher als ein Mechanismus für den Verlust von Helferzellen angesehen wird (Schindler 2006). Im Verlauf der unbehandelten HIV-Infektion ist parallel zum Abfall der CD4+ T-Zellen in der Regel ein Anstieg der Plasmavirämie zu beobachten. Im lymphatischen Gewebe entwickelt sich dabei als morphologisches Korrelat einer zunehmenden Immundefizienz an Stelle der follikulären Hyperplasie eine zunehmende Auflösung des FDC-Netzwerkes, eine progrediente Fibrose (Zeng 2011) sowie ein vermindertes virales „Trapping”.
Im lymphatischen Gewebe zeigt sich unter ART ein deutlicher Rückgang der Zahl der produktiv infizierten CD4+ T-Zellen (Tenner-Racz 1998). Trotzdem kann bei allen Patienten auch nach bis zu neunjähriger konstant effektiver ART weiterhin ein Pool latent infizierter CD4+ T-Zellen nachgewiesen werden (Chun 1997, Chun 2005). Die ständige Aktivierung latent infizierten CD4+ T-Zellen und die Virusverbreitung durch aktivierte Helferzellen führen dabei zu einer anhaltenden Viruspersistenz und Zerstörung des CD4+ T-Zell-Reservoirs. Die FDC dienen darüber hinaus zur Etablierung eines „Antigengedächtnisses“, da sie trotz unnachweisbarer Virusreplikation unter ART im Lymphknoten über Monate hinweg Hüllen- und Matrixantigene von HIV präsentieren und damit offenbar die Antikörperproduktion aufrechterhalten können (Popovic 2005).
Das HLA-System und die Immunantwort gegen HIV
CD8+ T-Zellen erkennen „ihr” Antigen im Zusammenhang mit HLA-Klasse-I-Antigenen auf antigenpräsentierenden Zellen, CD4+ T-Zellen benötigen das Antigen im Zusammenhang mit HLA-Klasse-II-Molekülen. Die Entwicklung einer spezifischen Immunantwort ist daher auch vom individuellen HLA-Muster abhängig: Antigenpräsentierende Zellen können HIV-Antigene in „Gruben” der HLA-Klasse-I-Moleküle so darbieten, dass CD8+ T-Lymphozyten optimal, eingeschränkt oder gar nicht aktiviert werden. In großen Patientenkohorten wurden HLA-Muster identifiziert, die mit einem günstigen oder ungünstigen Verlauf der Erkrankung assoziiert sind (Pereyra 2010). Allein das HLA-Muster ist für etwa 40 % der günstigen Verläufe bei Langzeitüberlebenden verantwortlich.
Homozygotie für HLA Bw4 gilt als protektiv. Allerdings wird sonst eine Heterozygotie der HLA-Klasse-I-Loci (versus Homozygotie) als günstig angesehen (Carrington 1999). Bereits 1996 beschrieb Kaslow, dass HLA B14, B27, B51, B57 und B63 sowie C8 mit einem langsameren Fortschreiten des Immundefektes assoziiert waren. HLA B18 gilt sogar als protektiv für die HIV-Infektion. HLA A23, B22, B35, B37 und B49 waren hingegen mit einem raschen Progress assoziiert. So waren alle Patienten mit HLA B35 nach 8 Jahren an AIDS erkrankt.
Es konnte auch gezeigt werden, dass nicht übereinstimmende HLA-Klasse-I-Antigene („Mismatch”) zwischen HIV-diskordanten Paaren einen protektiven Effekt haben (Lockett 2001). Für HLA B57 konnte nachgewiesen werden, dass tatsächlich HLA B57 restringierte CTL gegen HIV-Peptide vorhanden sind. Überhaupt übt die HLA-B restringierte Immunantwort einen größeren Selektionsdruck aus als die von HLA-A, und diese Qualität der Antwort wird schon bei der Selektion der Zellen im Thymus günstig beeinflusst (Kosmrlj 2010).
Bedacht werden muss jedoch, dass die Identifikation von HLA-Antigenen bzw. ‑Peptiden, die bei HIV-infizierten Patienten mit einem günstigen Verlauf assoziiert sind, nicht notwendigerweise auch sinnvolle Peptide sind, um eine protektive Immunantwort im Sinne einer Vakzinierung zu induzieren. So wurde gezeigt, dass CD8+ T-Lymphozyten HIV-exponierter, aber nicht-infizierter Afrikanerinnen andere Epitope erkennen als CD8+ T-Lymphozyten HIV-infizierter Afrikanerinnen (Kaul 2001). Offensichtlich kann es zu einem Verlust einer Epitop-Spezifität nach Serokonversion kommen. Dazu passen Ergebnisse, nach denen das individuelle HLA-Muster entscheidend die adaptive Immunantwort und die daraus resultierenden Virusmutationen beeinflusst (Friedrich 2004, Leslie 2004). So „zwingen“ die CTLs von z.B. Patienten mit HLA B57 und B58 die HI-Viren zu Mutationen im gag-Gen, die es dem Virus ermöglichen, der Immunantwort zu entkommen, dies jedoch oft zum Preis einer beeinträchtigten Replikationsfähigkeit. Wenn ein so selektioniertes Virus ein Individuum mit einem anderen HLA-Muster infiziert, kann die Viruslast bis zu 10fach niedriger liegen. Wenn mehrere Mutationen vorliegen (Goepfert 2008), verändert es sich jedoch vielfach wieder durch (Rück-)Mutation in der gag-Region, weil kein immunologischer Druck mehr besteht und das Virus somit wieder die volle Replikationsfähigkeit erlangt. Bei einer Infektion von SIV, das Fluchtmutationen enthält, kommt es nach Infektion zwischen Tieren mit identischem MHC nur vorübergehend zu einer Virämie mit Wildtypviren, bevor sich unter der identischen CTL-Antwort im neuen Tier wieder die ursprünglichen CTL-Fluchtmutationen etablieren (Barouch 2005). Gleiche HLA-Muster bei eineiigen Zwillingen wiederum führen, zumindest zu Beginn der Infektion, zu sehr ähnlichen CTL-Spezifitäten (Draenert 2006).
Seit 1997 ist bekannt, dass HIV-Patienten mit günstigem Verlauf HIV-spezifische CD4+ T-Zellen aufweisen (Rosenberg 1997). Die Identifikation protektiver bzw. ungünstiger HLA-Klasse-II-Antigene ist noch schlechter charakterisiert als für MHC-Klasse-I. An Kohorten von vertikal infizierten Kindern und HIV-infizierten Erwachsenen zeigte sich ein protektiver Effekt von HLA DR13 (Keet 1999).
Killer cell immunoglobulin like receptors (KIR) stellen Liganden von HLA-Klasse I Molekülen dar und können als stimulierende bzw. aktivierende Rezeptoren die Funktion von NK-Zellen kontrollieren. NK-Zellen (v. a. CD16+CD56dim) können durch KIR z.B. virusinfizierte Zellen oder Tumorzellen mit niedriger HLA-Klasse I-Expression identifizieren und diese Zellen durch zytotoxische Effekte zerstören. Wie wichtig dieser Faktor bei der Abwehr der HIV-Infektion ist, konnte bisher nicht sicher definiert werden (Fauci 2005). Eine kleinere Population von NK-Zellen (CD16–CD56bright) erfüllt eher regulatorische Funktionen. Diese Zellen sezernieren CC-Chemokine wie CCL3, CCl4, CCL5, die evtl. die Infektion von Zellen durch HIV inhibieren. Das Vorliegen von KIR-Polymorphismen (z. B. KIR3DS1-Allel) im Kontext mit bestimmten HLA-Antigenen korreliert sehr gut mit einem günstigen bzw. weniger raschen Krankheitsverlauf (Carrington 1999, Martin 2002). Die HIV-Infektion selbst führt in NK-Zellen zu einer Beeinträchtigung der antikörperabhängigen Zytotoxizität, einer reduzierten direkten zytolytischen Aktivität, zu Veränderungen im Expressionsmuster von KIR und dem Verlust von NK-Zellen. Darüber hinaus sind niedrige NK-Zellzahlen eventuell mit einer rascheren Krankheitsprogression ohne HIV-Therapie assoziiert.
Auch andere genetisch determinierte Faktoren können den individuellen Verlauf der HIV-Infektion beeinflussen. Eine Punktmutation im Promoter von IL-6 (G174) ist mit einer erhöhten Produktion von IL-6 und klinisch einer erhöhten Inzidenz von Kaposi-Sarkomen assoziiert. Das Vorliegen einer Homozygotie im IL-10 Promoter (Codon 592) ist in vitro durch eine verminderte Produktion von IL-10 charakterisiert und klinisch mit einem rascheren Progress der Erkrankung assoziiert.
Zusammenfassend muss konstatiert werden, dass es trotz eindrucksvoller statistischer Korrelation von genetischen Markern mit dem Krankheitsverlauf bislang keine Hinweise gibt, dass die Kenntnis dieser genetischen Marker für den individuellen Krankheitsverlauf von Bedeutung ist oder gar Entscheidungsrelevanz hat.
Die HIV-spezifische zelluläre Immunantwort
Zytotoxische T-Zellen (CTL) können virusinfizierte Zellen erkennen und eliminieren. Die bisherigen Erkenntnisse zur Rolle von CTL bei der HIV-Infektion zeigen deutlich, dass besonders gag-spezifische CTL, für den Verlauf der Erkrankung von wesentlicher Bedeutung sind. Wahrscheinlich spielen sie jedoch bei der primären Prävention gegen HIV nur eine untergeordnete Rolle.Verglichen mit Patienten mit raschem Krankheitsverlauf findet sich bei sogenannten HIV-Langzeitüberlebende eine hohe Zahl HIV-spezifischer Vorläufer-CTL mit breiter Spezifität gegen verschiedenste Virusproteine. Die protektive Rolle der CTL wird auch dadurch deutlich, dass das Auftreten von viralen „Escape”-Mutanten spät im Krankheitsverlauf (nach 9-12 Jahren) mit der Krankheitsprogression assoziiert ist (Goulder 1997). Eine HIV-spezifische CTL-Antwort wurde auch bei HIV-exponierten, aber nicht infizierten Personen beobachtet: nef-spezifische CTL konnten bei seronegativen heterosexuellen Partnern von HIV-1 infizierten Individuen, env-spezifische CTL bei seronegativen Krankenschwestern nach Nadelstichverletzungen nachgewiesen werden (Pinto 1995). Leider wurde aber auch gezeigt, dass bei Patienten trotz guter CTL-Antwort Superinfektionen mit einem anderen HIV-Isolat möglich sind, obwohl sich die viralen Epitope, gegen die die CTL-Antwort in vitro gemessen werden konnte, nur geringfügig zwischen beiden Isolaten unterschieden (Altfeld 2002).Der Nachweis einer CTL-Antwort korreliert mit der Suppression der Plasmavirämie nicht nur während der Serokonversion, sondern auch während Therapiepausen. Goonetilleke (2009) konnte nachweisen, dass die erste HIV-1-spezifische CTL-Antwort einen wichtigen Beitrag zur Kontrolle der Virämie während der akuten HIV-Infektion leistet. Mit neuesten bildgebenden Methoden konnten erstmals die Relationen von Abwehrzellen und infizierten Zielzellen im Tiermodell dargestellt werden und welchen Einfluss diese Verhältnisse auf die Beseitigung oder Kontrolle der Infektion haben (Li 2009). Noch unklar ist, warum diese temporär effektive CTL-Antwort im Verlauf der Erkrankung nachlässt. Mehrere Gründe sind denkbar. Durch die Bildung von „Escape”-Mutanten wird die Erkennung durch CTL unmöglich. Das nef-Protein kann seinerseits HLA-Klasse-I-Antigene herunterregulieren und somit ebenfalls ein Erkennen verhindern. CD8+ T-Zellen können auch von HIV infiziert werden (Saha 2001), was eventuell einige dieser Beobachtungen erklären könnte. Schließlich wurde gezeigt, dass während der HIV-Infektion die spezifischen CTL vermehrt PD-1 exprimieren. Dieses Molekül führt dann nach Interaktion mit seinem Partner PD-1 Ligand zu einer Dysfunktion der CTL. Es vermittelt offenbar auch Effekte, die zu einer beeinträchtigten Helferzellfunktion führen (Said 2010). Die Blockade der Wechselwirkung durch z. B. einen Antikörper verbesserte die CTL-Funktion der HIV-Patienten: Proliferation, Zytokinproduktion und Zytotoxizität steigen wieder an (Trautmann 2006, Velu 2009).Mit sensitiven Technologien können peripher zirkulierende, HIV-spezifische CTL direkt gemessen werden (Ogg 1998). Diese CTL sind zwar HIV-spezifisch, enthalten jedoch nur wenig Perforin (Appay 2000). HIV-spezifische CTL sind offenbar nur dann gute Effektorzellen, wenn sie gleichzeitig Interferon-γ und TNFα produzieren (Lichtenfeld 2004). Andere Arbeitsgruppen postulieren Störungen bei der Ausreifung HIV-spezifischer CTL im Vergleich zu z.B. CMV-spezifischen CTL (Harari 2002).CTL sind bei ihrer Proliferation und Aktivierung oft auf die Hilfe von CD4+ T-Zellen angewiesen (Bevan 2004). Rosenberg (1997) wies erstmals auf die Bedeutung HIV-spezifischer CD4+ T-Zellen hin und zeigte, dass eine ART in der Frühphase der HIV-Infektion mit der Persistenz HIV-spezifischer CD4-T-Zellantworten assoziiert ist. Die HIV-spezifischen CD4+ T-Lymphozyten sind vorwiegend gegen Epitope aus gag und nef gerichtet (Kaufmann 2004). Berücksichtigt man, dass HIV-spezifische T-Zellen zu den ersten CD4+ T-Zellen gehören, die nach Eindringen von HIV in den Organismus aktiviert werden, so muss davon ausgegangen werden, dass sie andererseits auch selber bevorzugt infiziert werden könnten (Douek 2002). Somit ist aktuell unklar, ob der häufig zu beobachtende Verlust von HIV-spezifischer CTL-Aktivität einen intrinsischen Defekt der CTL widerspiegelt oder aber sekundär einen Verlust von HIV-spezifischen CD4+ T-Zellen reflektiert.Verschiedene therapeutische Vakzinestrategien wurden bislang zumeist an Rhesusaffen mit dem Ziel getestet, eine SIV-spezifische CTL-Antwort zu induzieren (McElrath 2010). Vielversprechende Ergebnisse berichteten Lu und Mitarbeiter (2003), die SIV-infizierte Rhesusaffen mit autologen dendritischen Zellen, beladen mit inaktiviertem SIV, impften. Die geimpften Affen zeigten im Vergleich zu den Kontrolltieren einen dramatischen Abfall der Viruslast und SIV-spezifische, zelluläre und humorale Immunantworten. Mit einer ähnlichen Impfstrategie konnten bei Patienten HIV-spezifische CD4+ T-Zellen, die Interferon-γ und/oder Interleukin-2 produzieren, sowie gag-spezifische CD8+ T-Zellen induziert werden (Lu 2004).Im Gegensatz zu der CTL-Aktivität HIV-spezifischer CD8+ T-Zellen, die vom Zell-Zellkontakt HLA-identischer Zellen abhängt, wurde bereits 1986 eine lösliche CD8-Suppressoraktivität identifiziert (Walker 1986), deren Identität allerdings bis heute nicht restlos geklärt ist. Zumindest ein Teil der zu beobachtenden Aktivität, die die HIV-Vermehrung sowohl in CD4+T-Zellen als auch in Makrophagen hemmt, ist durch die ß-Chemokine MIP-1a, MIP-1ß und RANTES erklärbar (Cocchi 1995). Als andere Kandidaten wurden IL-16 (Baier 1995) und das Chemokin MDC (Pal 1997) diskutiert.
TH1/TH2 Immunantwort
Die HIV-spezifische humorale Immunantwort
Die Assoziation zwischen dem Auftreten einer humoralen Immunantwort gegen HIV und dem Krankheitsverlauf ist weniger gut charakterisiert. Im Affenmodell kann die Injektion eines Cocktails neutralisierender Antikörper eine mukosale SIV-Infektion verhindern (Ferrantelli 2004). Solche Antikörper scheinen in der sehr frühen Phase der HIV-Infektion besonders effektiv zu sein (Derdeyn 2004), und Tierversuche liefern erste Anhaltspunkte dazu, welche Antikörperkonzentrationen in Schleimhäuten für einen Schutz erforderlich sein werden (Hessell 2009). Die neutralisierenden Effekte lassen sich durch Interaktion mit Fc-Rezeptoren auf Makrophagen und NK-Zellen (Hessell 2007) sowie durch Wechselwirkungen mit CD4-gb120 Bindungsregion (Li 2007) erklären. Oft erkennen diese Antikörper konservierte Epitope, die auch für die virale Fitness sehr wichtig sind (Pietzsch 2010). Vieles spricht also dafür, dass für eine primäre Vakzine gegen HIV eine humorale Immunantwort unabdingbar ist, und in den letzten Jahren wurden große Fortschritte gemacht, die spezifischen Strukturen von HIV und seinen Oberflächenglykoproteinen zu charakterisieren, die durch neutralisierende Antikörper erkannt werden (Wu 2010, Zhou 2010), um davon neue Strategien für eine Vakzineentwicklung abzuleiten. Ähnlich wie bei den CTL üben neutralisierende Antikörper jedoch einen Selektionsdruck auf die Viren aus und bewirken dadurch Fluchtmutationen (Wei 2003). Werden bei Rhesusaffen B-Zellen mit Hilfe eines monoklonalen Antikörpers depletiert und die Tiere anschließend mit SIV infiziert, so zeigt sich kein Unterschied im Abfall der Plasmavirämie (Schmitz 2003). Ein verlangsamter Krankheitsverlauf korrelierte mit dem Fehlen einer Immunantwort gegen bestimmte Epitope von gp120 (Wong 1993), mit dem hochtitrigen Nachweis von p24-spezifischen Antikörpern (Hogervorst 1995) und der Persistenz neutralisierender Antikörper (Montefiori 1996) insbesondere gegen primäre HIV-Isolate und autologes Virus. LTNP haben häufig neutralisierende Antikörper gegen eine Vielzahl von Primärisolaten und eine Persistenz von Antikörpern gegen die eigenen Viren. Ob der Erhalt von neutralisierenden Antikörpern aber die Ursache der Protektion oder lediglich Ausdruck eines noch relativ intakten Immunsystems ist, ist unklar. Exponierte, aber nicht infizierte Personen haben möglicherweise eine lokale (mukosale IgA-Antikörper gegen HIV) oder eine temporäre Antikörperbildung, die ursächlich an der Protektion beteiligt ist, sich jedoch systemischen Messungen entzieht (Mazzoli 1997, Saha 2001).Therapeutisch wurde vor einigen Jahren versucht, Patienten mit weit fortgeschrittener HIV-Infektion mit angereichertem Plasma HIV-infizierter Patienten aus frühen Stadien zu behandeln. Ein signifikanter Effekt auf den Krankheitsverlauf war nicht feststellbar (Jacobson 1998). Erfolgreicher, aber noch nicht zufrieden stellend, verliefen Versuche mit passiver Immunisierung durch neutralisierende Antikörper bekannter Spezifität. Bei einigen akut oder chronisch HIV-infizierten Patienten ließ sich so die Viruslast nach Absetzen der ART zumindest vorübergehend kontrollieren (Trkola 2005).
Literatur
Ahuja SK, Kulkarni H, Catano G, et al. CCL3L1-CCR5 genotype influences durability of immune recovery during antiretroviral therapy of HIV-1-infected individuals. Nat Med 2008; 14:413-20.
Altfeld M, Allen TM, Yu XG, et al. HIV-1 superinfection despite broad CD8+ T-cell responses containing replication of the primary virus. WalkerNature. 2002; 420: 434-9.
Anzala AO, Ball TB, Rostron T, O’Brien SJ, Plummer FA, Rowland-Jones SL. CCR2-64I allele and genotype association with delayed AIDS progression in African women. Lancet 1998, 351: 1632-3.
Appay V, Nixon DF, Donahoe SM, et al. HIV-specific CD8+ T cells produce antiviral cytokines but are impaired in cytolytic function. J Exp Med 2000; 192: 63-75.
Arthos J, Cicala C, Martinelli E, et al. HIV-1 envelope protein binds to and signals through integrin α4β7, the gut mucosal homing receptor for peripheral T cells. Nat Immunol 2008; 9: 301-309.
Baier M, Werner A, Bannert N, Metzner K, Kurth R. HIV suppression by interleukin-16. Nature 1995, 378: 563.
Banda NK, Bernier J, Kurahara DK, et al. Cross-linking CD4 by HIV gp120 primes T cells for activation induced apoptosis. J Exp Med 1992, 176: 1099-106.
Barouch DH, Powers J, Truitt DM, et al. Dynamic immune responses maintain cytotoxic T lymphocyte epitope mutations in transmitted simian immunodeficiency virus variants. Nat Immunol 2005; 6: 247-52.
Barre-Sinoussi F, Chermann JC, Rey F, et al. Isolation of a T-lymphotropic retrovirus from a patient at risk for AIDS. Science 1983, 220: 868-71.
Beignon AS, McKenna K, Skoberne M, et al. Endocytosis of HIV-1 activates plasmacytoid dendritic cells via Toll-like receptor- viral RNA interactions. J Clin Invest 2005;
Bevan MJ. Helping the CD8(+) T-cell response. Nat Rev Immunol 2004; 4: 595-602.
Brenchley JM, Price DA, Schacker TW, et al. Microbial translocation is a cause of systemic immune activation in chronic HIV infection. Nat Med 2006; 12: 1365-71.
Carrington M, Nelson GW, Martin MP, et al. HLA and HIV-1: heterozygote advantage and B*35-Cw*04 disadvantage. Science 1999: 12, 28: 1748-52.
Carter CC, Onafuwa-Nuga A, McNamara LA, et al. HIV-1 infects multipotent progenitor cells causing cell death and establishing latent cellular reservoirs. Nat Med 2010;16:446-51.
Chan DC, Fass D, Berger JM, Kim PS. Core structure of gp41 from the HIV envelope glycoprotein. Cell 1997, 89: 263-73.
Chen B, Vogan EM, Gong H, Skehel JJ, Wiley DC, Harrison SC. Structure of an unliganded simian immunodeficiency virus gp120 core. Nature 2005; 433: 834-41.
Chen JD, Bai X, Yang AG, et al. Inactivation of HIV-1 chemokine co-receptor CXCR-4 by a novel intrakine strategy. Nat Med. 1997,; 3:1110-6.
Chun TW, Carruth L, Finzi D, et al. Quantification of latent tissue reservoirs and total body viral load in HIV-1 infection. Nature 1997,387:183-8.
Chun TW, Nickle DC, Justement JS, et al. HIV-infected individuals receiving effective antiviral therapy for extended periods of time continually replenish their viral reservoir. J Clin Invest 2005; 115: 3250-3255.
Cicala C, Arthos J, Censoplano N, et al. HIV-1 gp120 induces NFAT nuclear translocation in resting CD4+ T-cells. Virology 2005;
Ciccone EJ, Read SW, Mannon PJ, et al. Cycling of gut mucosal CD4+ T cells decreases after prolonged anti-retroviral therapy and is associated with plasma LPS levels. Mucosal Immunol 2010;3:172-81.
Clavel F, Guetard D, Brun-Vezinet F, Chamaret S, Rey MA, Santos-Ferreira O. Isolation of a new human retrovirus from West African patients with AIDS. Science 1986, 233: 343
Clerici M, Giorgi JV, Chou CC, et al. Cell-mediated immune response to HIV (HIV) type-1 in seronegative homosexual men with a recent sexual exposure to HIV-1. J Infect Dis 1992, 165: 1012-9.
Cocchi F, DeVico AL, Garzino-Demo A, Arya S, Gallo RC, Lusso P. Identification of RANTES, MIP-1a, and MIP-1ß as the major HIV-suppressive factors produced by CD8+ T cells. Science 1995, 270: 1811-5.
Collins KL, Chen BK, Walker BD, Baltimore D. HIV-1 nef protein protects infected primary cells against killing by cytotoxic T lymphocytes. Nature 1998, 391: 397-401.
Cullen BR. HIV-1 auxiliary proteins: making connections in a dying cell. Cell 1998, 93: 685-92.
Dalgleish AG, Beverley PC, Clapham PR, et al. The CD4 (T4) antigen is an essential component of the receptor for the AIDS retrovirus. Nature 1984, 312: 763-7.
Dean M, Carrington M, Winkler C, et al. Genetic restrictions of HIV-1 infection and progression to AIDS by a deletion allele of the CKR5 structural gene. Science 1996, 273: 1856-62.
De Clercq E, Schols D. Inhibition of HIV infection by CXCR4 and CCR5 chemokine receptor antagonists. Antivir Chem Chemother 2001; 12: Suppl 1:19-31
Deng H, Liu R, Ellmeier W, et al. Identification of a major co-receptor for primary isolates of HIV-1. Nature 1996, 381: 661-6.
Deng HK, Unutmaz D, Kewalramani VN, Littman DR. Expression cloning of new receptors used by simian and human immunodeficiency viruses. Nature 1997, 388: 296-300.
Derdeyn CA, Decker JM, Bibollet-Ruche F, et al. Envelope-constrained neutralization-sensitive HIV-1 after heterosexual transmission. Science 2004; 303: 2019-22.
Derdeyn CA, Silvestri G. Viral and host factors in the pathogenesis of HIV infection. Curr Opin Immunol 2005; 17: 366-73.
Dinoso JB, Kim SY, Wiegand AM, et al. Treatment intensification does not reduce residual HIV-1 viremia in patients on highly active antiretroviral therapy. Proc Natl Acad Sci U S A 2009m 106:9403-8.
Dolan MJ, Kulkarni H, Camargo JF, et al. CCL3L1 and CCR5 influence cell-mediated immunity and affect HIV-AIDS pathogenesis via viral entry-independent mechanisms. Nat Immunol 2007; 8: 1324-36.
Doranz BJ, Rucker J, Yi Y, et al. A dual-tropic primary HIV-1 isolate that uses fusin and the ß-chemo-kine receptors CKR-5, CKR-3, and CKR-2b as fusion cofactors. Cell 1996, 85: 1149-58.
Douek DC, Brenchley JM, Betts MR, et al. HIV preferentially infects HIV-specific CD4+ T cells. Nature 2002; 417: 95-98.
Draenert R, Allen TM, Liu Y, et al. Constraints on HIV-1 evolution and immunodominance revealed in monozygotic adult twins infected with the same virus. J Exp Med 2006; 203: 529-39.
Dragic T, Litwin V, Allaway GP, et al. HIV-1 entry into CD4+ cells is mediated by the chemokine receptor CC-CKR-5. Nature 1996, 381: 667-73.
Edwards TG, Hoffman TL, Baribaud F, et al. Relationships between CD4 independence, neutralization sensitivity and exposure of a CD4-induced epitope in an HIV-1 envelope protein. J Virol 2001, 75:5230-9.
Embretson J, Zupancic M, Ribas JL, et al. Massive covert infection of helper T lymphocytes and macrophages by HIV during the incubation period of AIDS. Nature 1993, 362: 359-62.
Estes JD, Harris LD, Klatt NR, et al. Damaged intestinal epithelial integrity linked to microbial translocation in pathogenic simian immunodeficiency virus infections. PLoS Pathog 2010;6. pii: e1001052.
Fatkenheuer G, Pozniak AL, Johnson MA, et al. Efficacy of short-term monotherapy with maraviroc, a new CCR5 antagonist, in patients infected with HIV-1. Nat Med 2005; 11: 1170-2.
Fauci AS, Mavilio D, Kottilil S. NK cells in HIV infection: Paradigm for protection or targets for ambush. Nat Rev Immunol 2005; 5: 835-43.
Feng Y, Broder CC, Kennedy PE, Berger EA. HIV-1 entry cofactor: functional cDNA cloning of a seven-transmembrane, G protein-coupled receptor. Science 1996, 272: 872-7.
Ferrantelli F, Rasmussen RA, Buckley KA, et al. Complete protection of neonatal rhesus macaques against oral exposure to pathogenic simian-human immunodeficiency virus by human anti-HIV monoclonal antibodies. J Infect Dis 2004; 189: 2167-2173.
Forssmann WG, The YH, Stoll M, et al. Short-term monotherapy in HIV-infected patients with a virus entry inhibitor against the gp41 fusion peptide. Sci Transl Med 2010; 2:63re3.
Friedrich TC, Dodds EJ, Yant LJ, et al. Reversion of CTL escape-variant immunodeficiency viruses in vivo. Nat Med 2004; 10: 275-81.
Gallo RC, Sarin PS, Gelmann EP, et al. Isolation of human T cell leukemia virus in acquired immune deficiency syndrome (AIDS). Science 1983, 220: 865-7.
Ganesh L, Burstein E, Guha-Niyogi A, et al. The gene product murr1 restricts HIV-1 replication in resting CD4+ lymphocytes. Nature 2003; 426: 853-857.
Geijtenbeek TB, Torensma R, van Vliet SJ, et al. Identification of DC-SIGN, a novel dendritic cell-specific ICAM-3 receptor that supports primary immuene responses. Cell 2000, 100: 575-85.
Gelderblom HR, Gentile M, Scheidler A, Özel M, Pauli G. Zur Struktur und Funktion bei HIV. AIFO 1993, 5: 231.
Goepfert PA, Lumm W, Farmer P, et al. Transmission of HIV-1 Gag immune escape mutations is associated with reduced viral load in linked recipients. J Exp Med 2008; 205:1009-17.
Goonetilleke N, Liu MK, Salazar-Gonzalez JF, et al. The first T cell response to transmitted/founder virus contributes to the control of acute viremia in HIV-1 infection. J Exp Med 2009, 206:1253-72.
Goulder PJ, Phillips RE, Colbert RA, et al. Late escape from an immundominant cytotoxic T-lymphocyte response associated with progression to AIDS. Nat Med 1997, 3: 212-7.
Gringhuis SI, van der Vlist M, van den Berg LM, den Dunnen J, Litjens M, Geijtenbeek TB. HIV-1 exploits innate signaling by TLR8 and DC-SIGN for productive infection of dendritic cells. Nat Immunol 2010;11:419-26.
Harari A, Rizzardi GP, Ellefsen K et al. Analysis of HIV-1 and CMV specific memory CD4 T cell responses during primary and chronic infec-tion. Blood 2002; 100: 1381-1387.
Herbeuval JP, Hardy AW, Boasso A, et al. Regulation of TNF-related apoptosis-inducing ligand on primary CD4+ T cells by HIV-1: role of type I IFN-producing plasmacytoid dendritic cells. Proc Natl Acad Sci USA 2005; 102: 13974-9.
Hessell AJ, Hangartner L, Hunter M, et al. Fc receptor but not complement binding is important in antibody protection against HIV. Nature 2007; 449: 101-4.
Hessell AJ, Poignard P, Hunter M et al. Effective, low-titer antibody protection against low-dose repeated mucosal SHIV challenge in macaques. Nat Med 2009;15:951-4.
Hogervorst E, Jurriaans S, de Wolf F, et al. Predictors for non-and slow progression in HIV type 1 infection: low viral RNA copy numbers in serum and maintenance of high HIV-1 p24-specific but not V3-specific antibody levels. J Infect Dis 1995, 171: 811-21.
Huang J, Wang F, Argyris E, et al. Cellular microRNAs contribute to HIV-1 latency in resting primary CD4+ T lymphocytes. Nat Med 2007; 13:1241-7.
Jacobson JM. Passive immunizytion for the treatment of HIV infection. Mt Sinai J Med 1998; 65: 22 – 26.
Jacobson JM, Israel RJ, Lowy I, et al. Treatment of advanced human immunodeficiency virus type 1 disease with the viral entry inhibitor PRO 542. Antimicrob Agents Chemother 2004; 48: 423-9.
Kaslow RA, Carrington M, Apple R, et al. Influence of combinations of human major histocompatibility complex genes on the course of HIV-1 infection. Nat Med 1996: 2: 405-11.
Kaufmann DE, Bailey PM, Sidney J, et al. Comprehensive analysis of HIV type 1-specific CD4 responses reveals marked immunodominance of gag and nef and the presence of broadly recognized peptides. J Virol 2004; 78: 4463-77.
Kaul R, Rowland-Jones SL, Kimani J, et al. New insights into HIV-1 specific cytotoxic T-lymphocyte responses in exposed, persistently seronegative Kenyan sex workers. Immunol Lett 2001, 79: 3-13.
Keele BF, Giorgi EE, Salazar-Gonzalez JF, et al. Identification and characterization of transmitted and early founder virus envelopes in primary HIV-1 infection. Proc Natl Acad Sci U S A. 2008;105:7552-7.
Keet IP, Tang J, Klein MR, et al. Consistent associations of HLA class I and II and transporter gene products with progression of HIV type 1 infection in homosexual men. J Infect Dis 1999, 180: 299-309.
Kilby JM, Hopkins S, Venetta TM, et al. Potent suppression of HIV-1 replication in humans by T-20, a peptide inhibitor of gp41-mediated virus entry. Nat Med 1998, 4: 1302-7.
Kirchhoff F, Greenough TC, Brettler DB, Sullivan JL, Desrosiers RC. Brief report: Absence of intact nef sequences in a long-term survivor with nonprogressive HIV-1 infection. N Engl J Med 1995, 332: 228-32
Klatt NR, Harris LD, Vinton CL et al. Compromised gastrointestinal integrity in pigtail macaques is associated with increased microbial translocation, immune activation, and IL-17 production in the absence of SIV infection. Mucosal Immunol 2010;3:387-98.
Klatzmann D, Champagne E, Chamaret S, et al. T-lymphocyte T4 molecule behaves as the receptor for human retrovirus LAV. Nature 1984, 312: 767-8.
Kohl NE, Emini EA, Schleif WA, et al. Active HIV protease is required for viral infectivity. Proc Natl Acad Sci USA, 1988, 85: 4686-90.
Kosmrlj A, Read EL, Qi Y et al. Effects of thymic selection of the T-cell repertoire on HLA class I-associated control of HIV infection. Nature 2010; 465:350-4.
Kühl A, Münch J, Sauter D, et al. Calcium-modulating cyclophilin ligand does not restrict retrovirus release. Nat Med. 2010;16:155-6
Larsson M, Fonteneau JF, Lirvall M, Haslett P, Lifson JD, Bhardwaj N. Activation of HIV-1 specific CD4 and CD8 T cells by human dendritic cells: roles for cross-presentation and non-infectious HIV-1 virus. AIDS 2002; 16: 1319-29.
Lataillade M, Kozal MJ. The hunt for HIV-1 integrase inhibitors. AIDS Patient Care STDS 2006; 20: 489-501.
Lazaro E, Kadie C, Stamegna P et al. Variable HIV peptide stability in human cytosol is critical to epitope presentation and immune escape. J Clin Invest 2011 (in press).
Leslie AJ, Pfafferott KJ, Chetty P, et al. HIV evolution: CTL escape mutation and reversion after transmission. Nat Med 2004; 10: 282-9.
Levy JA, Mackewicz CE, Barker E. Controlling HIV pathogenesis: the role of thenoncytotoxic anti-HIV response of CD8+ T cells. Immunol Today 1996,17: 217-24.
Lewin SR, Rouzioux C. HIV cure and eradication: how will we get from the laboratory to effective clinical trials? AIDS. 2011;25:885-97.
Li Q, Skinner PJ, Ha SJ et al. Visualizing antigen-specific and infected cells in situ predicts outcomes in early viral infection. Science 2009;323:1726-9.
Li Y, Migueles SA, Welcher B, et al. Broad HIV-1 neutralization mediated by CD4-binding site antibodies. Nat Med 2007; 13:1032-4.
Liao F, Alkhatib G, Peden KWC, Sharma G, Berger EA, Farber JM. STRL-33, a novel chemokine receptor-like protein, functions as a fusion cofactor for both macrophage-tropic and T cell line-tropic HIV-1. J Exp Med 1997, 185: 2015-23.
Lichterfeld M, Yu XG, Waring MT, et al. HIV-1 specific cytotoxicity is preferentially mediated by a subset of CD8+ T cells producing both interferon gamma and tumor necrosis factor alpha. J Exp Med 2004; 104, 487-494.
Liu R, Paxton WA, Choe S, et al. Homozygous defect in HIV-1 coreceptor accounts for resistance of some multiply-exposed individuals to HIV-1 infection. Cell 1996, 86: 367-77.
Liu SL, Schacker T, Musey L, et al. Divergent patterns of progression to AIDS after infection from the same source: HIV type 1 evolution and antiviral responses. J Virol 1997, 71: 4284-95.
Lockett SF, Robertson JR, Brettle RP, et al. Mismatched human leukocyte antigen alleles protect against heterosexual HIV transmission. JAIDS 2001: 27: 277-80.
Lore K, Smed-Sorensen A, Vasudevan J, Mascola JR, Koup RA. Myeloid and plasmacytoid dendritic cells transfer HIV-1 preferentially to antigen-specific CD4+ T cells. J Exp Med 2005; 201: 2023-33.
Lu W, Arraes LC, Ferreira WT, Andrieu JM. Therapeutic dendritic-cell vaccine for chronic HIV-1 infection. Nat Med 2004; 10: 1359-1365.
Lu W, Wu X, Lu Y, Guo W, Andrieu JM. Therapeutic dendritic-cell vaccine for simian AIDS. Nat Med 2003; 9: 13-14.
Manel N, Hogstad B, Wang Y, Levy DE, Unutmaz D, Littman DR. A cryptic sensor for HIV-1 activates antiviral innate immunity in dendritic cells. Nature 2010;467:214-7.
Maranon C, Desoutter JF, Hoeffel G, Cohen W, Hanau D, Hosmalin A. Dendritic cells cross-present HIV antigens from live as well as apopto-tic infected CD4+ T lymphocytes. Proc Natl Acad Sci U S A 2004; 101: 6092-7.
Mariani R, Chen D, Schröfelbauer B et al. Species-specific exclusion of APOBEC3G from HIV-1 virions by vif. Cell 2003; 114: 21-31
Martin MP, Gao X, Lee JH, et al. Epistatic interaction between KIR3DS1 and HLA-B delays the progression to AIDS. Nat Genet 2002, 31:429-34.
Mazzoli S, Trabattoni D, Lo Caputo S, et al. HIV-specific mucosal and cellular immunity in HIV-seronegative partners of HIV-seropositive individuals. Nat Med 1997, 3:1250-7.
McElrath MJ, Haynes BF. Induction of immunity to human immunodeficiency virus type-1 by vaccination. Immunity 2010;33:542-54.
Miller RH, Sarver N. HIV accessory proteins as therapeutic targets. Nat Med 1997, 3: 389-94.
Miyauchi K, Kim Y, Latinovic O, Morozov V, Melikyan GB. HIV enters cells via endocytosis and dynamin-dependent fusion with endosomes. Cell 2009;137:433-44.
Montefiori DC, Pantaleo G, Fink LM, et al. Neutralizing and infection-enhancing antibody responses to HIV type 1 in long-term nonprogres-sors. J Infect Dis 1996, 173: 60-7.
Neil SJD, Zang T, Bieniasz. Thetherin inhibits retrovirus relase and is antagonized by HIV-1 Vpu. Nature 2009; 451: 425-431.
O’Brien WA, Grovit-Ferbas K, Namazi A, et al. HIV-type 1 replication can be increased in peripheral blood of seropositive patients after influenza vaccination. Blood 1995, 86: 1082-9.
Ogg GS, Jin X, Bonhoeffer S, et al. Quantitation of HIV-1-specific cytotoxic T lymphocytes and plasma load of viral RNA. Science 1998, 279: 2103-6.
Olson W, Israel R, Jacobson J, et al. Viral resistance and pharmacologic analyses of phase I/II study patients treated with the HIV-1 entry inhibitor PRO542. Abstract 561, 10th CROI 2003, Boston.
Pal R, Garzino-Demo A, Markham PD, et al. Inhibition of HIV-1 infection by the ß-chemokine MDC. Science 1997, 278: 695-8.
Pantaleo G, Graziosi C, Demarest JF, et al. HIV infection is active and progressive in lymphoid tissue during the clinically latent stage of disease. Nature 1993, 362: 355-8.
Pantaleo G, Koup RA. Correlates of immune protection in HIV-1 infection: what we know, what we don´t know, what we should know. Nat Med 2004; 10: 806-10.
Pertel T, Hausmann S, Morger D et al. TRIM5 is an innate immune sensor for the retrovirus capsid lattice. Nature 2011;472:361-5.
Pereyra F, Jia X, McLaren Pj et al.The major genetic determinants of HIV-1 control affect HLA class I peptide presentation. Science 2010;330:1551-7.
Peter F. HIV nef: The mother of all evil? Immunity, 1998, 9: 433-7.
Pietzsch J, Scheid JF, Mouquet H et al. Human anti-HIV-neutralizing antibodies frequently target a conserved epitope essential for viral fitness. J Exp Med 2010; 207:1995-2002.
Pinto LA, Sullivan J, Berzofsky JA, et al. Env-specific cytotoxic T lymphocyte responses in HIV seronegative health care workers occupation-ally exposed to HIV contaminated body fluids. J Clin Invest 1995, 96: 867-76.
Pion M, Granelli-Piperno A, Mangeat B, et al. APOBEC3G/3F mediates intrinsic resistance of monocyte-derived dendritic cells to HIV-1 infection. J Exp Med 2006; 203: 2887-93.
Popovic M, Tenner-Racz K, Pelser C, et al. Persistence of HIV-1 structural proteins and glycoproteins in lymph nodes of patients under highly active antiretroviral therapy. Proc Natl Acad Sci U S A 2005; 102: 14807-12.
Rosenberg ES, Billingsley JM, Caliendo AM, et al. Vigorous HIV-1-specific CD4+ T cell responses associated with control of viremia. Science 1997, 278: 1447-50.
Saha K, Zhang J, Gupta A et al. Isolation of primary HIV-1 that target CD8+ T lymphocytes using CD8 as a receptor. Nat Med 2001, 7: 65-72.
Said EA, Dupuy FP, Trautmann L, et al. Programmed death-1-induced interleukin-10 production by monocytes impairs CD4+ T cell activation during HIV infection. Nat Med 2010;16:452-9.
Sarkar I, Hauber I, Hauber J, Buchholz F. HIV-1 proviral DNA excision using an evolved recombinase. Science 2007; 316: 1912-5.
Sauce D, Larsen M, Fastenackels S et al. HIV disease progression despite suppression of viral replication is associated with exhaustion of lymphopoiesis. Blood. 2011 (in press).
Sauter D, Schindler M, Specht A ,et al. Tetherin-driven adaptation of Vpu and Nef function and the evolution of pandemic and nonpandemic HIV-1 strains. Cell Host Microbe 2009, 6:409-21.
Schindler M, Münch J, Kutsch O, et al. Nef-mediated suppression of T cell activation was lost in a lentiviral lineage that gave rise to HIV-1. Cell 2006; 125: 1055-67.
Schmitz JE, Kuroda MJ, Santra S, et al. Effect of humoral immune responses on controlling viremia during primary infection of rhesus monkeys with simian immunodeficiency virus. J Virol 2003; 77: 2165-2173.
Schooley RT, Merigan TC, Gaut P, et al. Recombinant soluble CD4 therapy in patients with AIDS and ARC. Ann Intern Med 1990, 112: 247-53.
Schroder AR, Shinn P, Chen H, Berry C, Ecker JR, Bushman F. HIV-1 integration in the human genome favors active genes and local hotspots. Cell 2002; 110: 521-9.
Sheehy AM, Gaddis NC, Choi JD, et al. Isolation of a human gene that inhibits HIV-1 infection and is suppressed by the viral vif protein. Nature 2002; 418: 646-650.
Song E, Zhu P, Lee SK, et al. Antibody mediated in vivo delivery of small interfering RNAs via cell-surface receptors. Nat Biotechnol 2005; 23: 709-17.
Stacey AR, Norris PJ, Qin L et al. Induction of a striking systemic cytokine cascade prior to peak viremia in acute human immunodeficiency virus type 1 infection, in contrast to more modest and delayed responses in acute hepatitis B and C virus infections. J Virol 2009;83:3719-33.
Stremlau M, Owens CM, Perron MJ et al. The cytoplasmic body component TRIM5alpha restricts HIV-1 infection in Old World monkey s. Nature 2004; 427: 848-853.
Tenner-Racz K, Stellbrink HJ, van Lunzen J, et al. The unenlarged lymph nodes of HIV-1-infected, asymptomatic patients with high CD4 T cell counts are sites for virus replication and CD4 T cell proliferation. The impact of HAART. J Exp Med 1998, 187: 949-59.
Trautmann L, Janbazian L, Chomont N, et al. Upregulation of PD-1 expression on HIV-specific CD8+ T cells leads to reversible immune dysfunction. Nat Med 2006; 12: 1198-202.
Trkola A, Kuster H, Rusert P, et al. Delay of HIV-1 rebound after cessation of antiretroviral therapy through passive transfer of human neutral-izing antibodies. Nat Med 2005; 11: 615-22.
Turelli P, Mangeat B, Jost S, Vianin S, Trono D. Inhibition of hepatitis B virus replication by APOBEC3G. Science 2004; 303: 1829.
Varthakavi V, Heimann-Nichols E, Smith RM et al. Identification of calcium-modulating cyclophilin ligand as a human host restriction to HIV-1 release overcome Vpu. Nat Med 2008; 14: 641-647.
van Grevenynghe J, Procopio FA, He Z, et al. Transcription factor FOXO3a controls the persistence of memory CD4+ T cells during HIV infection. Nat Med 2008; 14: 266-274.
Veazey RS, Klasse PJ, Schader SM, et al. Protection of macaques from vaginal SHIV challenge by vaginally delivered inhibitors of virus-cell fusion. Nature 2005; 438: 99-102.
Velu V, Titanji K, Zhu B, et al. Enhancing SIV-specific immunity in vivo by PD-1 blockade. Nature 2009; 458: 206-10
Walker CM, Moody DJ, Stites DP, Levy JA. CD8+ lymphocytes can control HIV infection in vitro by suppressing viral replication. Science 1986, 234: 1563-6.
Wei P, Garber ME, Fang SM, Fischer WH, Jones KA. A novel CDK9-associated C-type cyclin interacts directly with HIV-1 Tat and mediates its high-affinity, loop-specific binding to TAR RNA. Cell 1998, 92: 451-62.
Wei X, Decker JM, Wang S, et al. Antibody neutralization and escape by HIV-1. Nature 2003; 422: 307-12.
Winkler C, Modi W, Smith MW, et al. Genetic restriction of AIDS pathogenesis by an SDF-1 chemokine gene variant. Science 1998, 279: 389-93.
Wong MT, Warren RQ, Anderson SA, et al. Longitudinal analysis of the humoral immune response to HIV type 1 gp160 epitopes in rapidly progressing and nonprogressing HIV-1 infected subjects. J Infect Dis 1993, 168: 1523-7.
Wu X, Yang ZY, Li Y et al. Rational design of envelope identifies broadly neutralizing human monoclonal antibodies to HIV-1. Science 2010;329:856-61.
Wong-Staal F. HIVes and their replication. In: Fundamental Virology, Ed.: Fields BN, Knipe DM et al. Raven Press, Ltd., New York 1991.
Zack JA, Arrigo SJ, Weitsman SR, Go AS, Haislip A, Chen ISY. HIV-1 entry into quiescent primary lymphocytes: Molecular analysis reveals a labile, latent viral structure. Cell 1990, 61: 213-22.
Zeng M, Smith AJ, Wietgrefe SW, et al. Cumulative mechanisms of lymphoid tissue fibrosis and T cell depletion in HIV-1 and SIV infections. J Clin Invest. 2011;121:998-1008.
Zhou T, Georgiev I, Wu X et al. Structural basis for broad and potent neutralization of HIV-1 by antibody VRC01. Science, 2010;329:811-7.
Zou YR, Kottmann AH, Kuroda M, Taniuchi I, Littman DR. Function of the chemokine receptor CXCR4 in haematopoiesis and in cerebellar development. Nature 1998, 393: 595-9.