– von Jürgen Kurt Rockstroh –
Die erworbene Immunschwäche AIDS (Acquired Immune Deficiency Syndrome) wurde erstmals 1981 als klinische Entität beschrieben. Die ersten Berichte gingen dabei auf eine ungewöhnliche Häufung bis dahin seltener Erkrankungen wie Kaposi-Sarkomen (KS) und Pneumocystis-Pneumonien (PCP) zurück. Obwohl diese Krankheitsbilder gelegentlich in verschiedenen Bevölkerungsgruppen vorkommen (so das KS bei älteren Männern aus dem Mittelmeerraum oder die PCP bei Leukämiepatienten nach intensiver Chemotherapie), war das Auftreten dieser Indikatorerkrankungen für einen Immundefekt bei bislang gesunden jungen Menschen noch nie beobachtet worden. Angesichts der anfangs betroffenen Patientengruppe, nämlich Männer, die Sex mit Männern haben (MSM), wurden Erkrankung und Betroffene stark stigmatisiert. Nach dem man zunächst die Ursache in den spezifischen Lebensstilen vermutet hatte, konnte schließlich 1983 das Humane Immunschwäche Virus (HIV) als auslösender Erreger von AIDS identifiziert werden.
Bereits 1987 wurde mit AZT (Zidovudin, Retrovir®) die erste antiretrovirale Substanz eingeführt. Wenngleich diese – als Monotherapie – die HIV-Vermehrung nur ungenügend unterdrückte, gelang es so zumindest, Symptome der HIV-Infektion kurzfristig zu verbessern und das Auftreten von AIDS zeitlich etwas zu verzögern. Was dann folgte, bleibt in der Medizin einmalig: innerhalb weniger Jahre nach ihrer Entdeckung wurde aus einer unweigerlich tödlichen Erkrankung eine, die sich dauerhaft und effektiv behandeln ließ. Durch die rasche Einführung weiterer Medikamentenklassen und der so genannten hochaktiven antiretroviralen Therapie (HAART, ein Begriff, der in diesem Buch inzwischen durch ART ersetzt wurde), gelang und gelingt es dauerhaft, die Virusvermehrung zu unterdrücken und ein Fortschreiten der Erkrankung zu verhindern – vorausgesetzt, die Medikamente werden regelmäßig eingenommen und toleriert. Langzeittoxizitäten und Resistenzen bedingten die Suche und Identifizierung weiterer viel versprechender Substanzen mit anderem Wirkmechanismus oder günstigerem Resistenzprofil. Auch Einnahmebedingungen und Verträglichkeit wurden verbessert. So stehen im Jahr 2011 mehrere HIV-Therapien mit lediglich 1-3 Tabletten einmal täglich zur Verfügung, was vor allem durch Fixdosis-Kombinationen möglich geworden ist.
Dies alles soll allerdings nicht darüber hinwegtäuschen, dass eine lebenslange medikamentöse Behandlung erhebliche Probleme bereiten wird – sowohl was Therapietreue als auch mögliche Langzeittoxizitäten (bislang begrenzte Erfahrung über zehn Jahre) angeht. Eine Infektion mit HIV sollte weiter unbedingt vermieden werden. Daher müssen unsere Anstrengungen neben einer weiteren Verbesserung der ART und neuen Konzepten wie etwa der Eradikation vor allem der Prävention gelten, um eine weitere Ausbreitung zu verhindern.
Die HIV-Epidemie
1981 erschienen in Morbity and Mortality Weekly Report und später im New England Journal of Medicine die ersten drei klinischen Beschreibungen von AIDS, die sowohl eine Epidemie ambulant erworbener Pneumocystis-Pneumonien meist zusammen mit oralem Soor bei zuvor gesunden homosexuellen Männern wie auch chronisch ulzerierende perianale Herpesinfektionen umfassten (Gottlieb 1981a, Gottlieb 1981b, Masur 1981, Siegal 1981).
Wenig später, im Juni 1982, wurde eine Notiz der Centers for Disease Control (CDC) über drei PCP-Fälle bei Hämophilen veröffentlicht (CDC 1982a). Im selben Jahr wurden auch noch ein klinischer Fall einer Kryptosporidiose bei einem Hämophilen aus Pennsylvania (Eyster 1982) und eine AIDS-Erkrankung eines Kleinkindes nach einer Bluttransfusion publiziert (CDC 1982b). Das Auftreten von AIDS bei Hämophilen löste eine Diskussion aus, ob AIDS möglicherweise eine virusbedingte Erkrankung sei (Marx 1982). Vor allem die Ähnlichkeit der Risikopopulationen für AIDS und für Hepatitis B ließ eine virale Genese von AIDS vermuten.
Untersuchungen der AIDS-Patienten aus verschiedenen Risikokollektiven konnten rasch Gemeinsamkeiten aufzeigen: So waren bei allen Patienten, verglichen mit gesunden Kontrollpersonen, die CD4-positiven T-Lymphozyten erniedrigt. Dagegen lagen ein relativer und absoluter Anstieg der CD8-positiven T-Lymphozyten und eine eingeschränkte, mitogen-induzierte Proliferationsfähigkeit der Lymphozyten vor (Gottlieb 1981, Masur 1981, Siegal 1981, Mildvan 1982, Stahl 1982). Schnell wurde deutlich, dass eine manifeste Erkrankung jedoch keine Bedingung für den Immundefekt war. Ein Defekt der zellulären Immunität, verbunden mit einer Lymphadenopathie, wurde bereits sehr früh bei ansonsten asymptomatischen Männern, die Sex mit Männern haben, beschrieben (Kornfeld 1982, Stahl 1982). Im Januar 1983 erschien eine Beschreibung zweier Hämophiler mit Lymphadenopathiesyndrom, die beide erhebliche Störungen der zellulären Immunität aufwiesen (Ragni 1983). Sie ließ vermuten, dass es sich bei der Lymphadenopathie und der Störung der zellulären Immunität um ein Vorstadium von AIDS handelte und dass eine Übertragung des AIDS-Erregers durch Blutprodukte wahrscheinlich war. Nachfolgend erschien eine Fülle von Arbeiten, die über Veränderungen der zellulären Immunität bei Hämophilen berichteten. Im Wesentlichen zeigte sich eine verminderte CD4/CD8-Ratio, die als Ergebnis einer relativen und/oder absoluten Verminderung CD4-T-Lymphozyten bei meist bereits erhöhten CD8-T-Lymphozyten angesehen wurde. Lediglich bei Patienten, die mit geringen Mengen an Faktor VIII behandelt werden mussten, oder aber deren Faktor VIII aus kleinen Donor-Pools bestanden, fanden sich regelrechte Lymphozytensubpopulationen (Luban 1983, Rasi 1984).
Die immunologischen Befunde bei Hämophilen wurden zunächst kontrovers diskutiert. Zum Teil wurden sie mit der chronischen Antigenbelastung der Patienten durch die Faktor-VIII-Gabe erklärt. Andere Gruppen wiederum hielten diese Erklärung für unwahrscheinlich, da Hämophile bis zu dem Auftreten von AIDS kein erhöhtes Risiko für eine Infektion aufgewiesen hatten als andere Bevölkerungsgruppen (ausgenommen virale Infektionen, insbesondere Hepatitis B und Non-A-Non-B-Hepatitis über die Verabreichung von Blutprodukten). Insgesamt wurde zu diesem Zeitpunkt noch keine Veranlassung gesehen, das Konzept der Faktorenbehandlung bei Hämophilen infrage zu stellen (Anonymous 1983, Goldsmith 1983). Als mögliche alternative Erklärung für AIDS, vor allen Dingen innerhalb der Risikogruppe der Männer, die Sex mit Männern hatten, wurde die Koinfektion mit dem humanen Zytomegalievirus, Drogengebrauch, Inhalation von Amylnitrat (Poppers) und Exposition zu fremden Eiweißen (Spermatozoa) diskutiert (Essex 1997).
Im Jahr 1983 wurde von verschiedenen Forschergruppen die Vermutung geäußert, dass der mögliche Auslöser von AIDS eine Variante des T-lymphotropen Retrovirus (HTLV-I) sein könnte, das 1980 von Gallo und Kollegen entdeckt worden war (Essex 1983, Gallo 1983). Mehrere Argumente sprachen für diese Hypothese. So war HTLV-I zu diesem Zeitpunkt das einzige bekannte humane Virus mit dem Potential, CD4-T-Lymphozyten zu infizieren (Poiesz 1980). Hinzu kam, dass HTLV-I über dieselben Transmissionswege übertragen wurde wie der mögliche Erreger von AIDS, nämlich über sexuelle Kontakte, über Blut und perinatal (Essex 1982).
Erste Versuche, ein Virus zu isolieren, das mit HTLV-I oder -II verwandt war, waren nur zum Teil erfolgreich. Obwohl kreuzreagierende Antikörper mit HTLV-verwandten Genomsequenzen in einer kleinen Anzahl von AIDS-Patienten gefunden werden konnten, war die Reaktivität insgesamt doch sehr schwach und legte somit nur eine HTLV-Koinfektion nahe. Eher ließen diese Beobachtungen an die ätiologische Rolle eines weiter entfernten, schwach reaktiven Virus denken. In der Tat konnte dann wenig später durch die Isolation von HTLV-III, das später als humanes Immundefizienz-Virus Typ 1 (HIV-1) umbenannt wurde, der Erreger von AIDS identifiziert werden (Barre-Sinoussi 1983, Popovic 1984). Im Jahr 2008 wurde der französischen Forschergruppe um Luc Montagnier und Francoise Barré-Sinoussi für diese Arbeiten der Nobelpreis für Medizin verliehen.
Übertragungswege
HIV wird im Wesentlichen übertragen durch
- ungeschützten sexuellen Kontakt mit einem infizierten Partner (insbesondere bei nachweisbarer HI-Viruslast)
- gemeinsamen Gebrauch von Spritzenutensilien, meist unter Drogenabhängigen
- im Rahmen der Übertragung von einer HIV-infizierten Mutter auf das Neugeborene (vor der Geburt, unter der Geburt oder durch Stillen)
Alle anderen meist kasuistisch beschriebenen Infektionen sind ausgesprochen selten. Hierzu gehört die Übertragung im Rahmen von Transfusionen von Blut oder Blutprodukten in den Ländern, in denen Blutspenden nicht regelmäßig auf HIV untersucht werden.
Absolute Raritäten sind Kontakt von infiziertem Blut mit offenen Wunden oder Schleimhäuten, oder auch eine HIV-Transmission über eine Bisswunde (Bartholomew 2008). Kürzlich wurden drei Fälle publiziert, in denen Mütter ihre Neugeborenen vermutlich durch vorgekaute Nahrung infizierten (Gaur 2008). Dies sind aber allesamt eher kasuistische Mitteilungen. Große Sammelstatistiken, insbesondere des CDC, die sich mit anderen möglichen Übertragungswegen beschäftigt haben, konnten klar und deutlich zeigen, dass das normale tägliche Miteinander, einschließlich Benutzung einer gemeinsamen Toilette oder Trinken aus demselben Glas, zu keiner Übertragung führt. Auch im Gesundheitswesen konnte in einer Sammelstatistik über Speichelkontakte, Kontakte zu Urin, oder aber infektiösem Blut in Kontakt zu Haut allesamt keine einzige Ansteckung festgestellt werden (Henderson 1990).
Nachfolgend sollen die verschiedenen Übertragungswege kurz vorgestellt und hinsichtlich begünstigender Faktoren und Risiken besprochen werden.
Sex
Der wichtigste Infektionsweg für HIV bleibt der Sexualkontakt. Voraussetzung für die sexuelle Übertragung ist der direkte Kontakt mit infizierten Körpersekreten bzw. -flüssigkeiten. Hierbei finden sich die höchsten Viruskonzentrationen im Blut und in der Samenflüssigkeit. In einer Untersuchung zur heterosexuellen Transmission bei Partnerinnen HIV-positiver Hämophiler in Bonn konnte eine Serokonversionsrate für HIV von 10 % festgestellt werden (Rockstroh 1995). Dabei war das Risiko der sexuellen Transmission deutlich erhöht, wenn beim Partner eine fortgeschrittene Immundefizienz bzw. ein fortgeschrittenes klinisches Stadium der HIV-Infektion vorlag. Es sei an dieser Stelle explizit darauf hingewiesen, dass für die individuelle Risikoexposition eine Berechnung des Transmissionsrisikos nicht möglich ist, da dieses durch viele Begleitumstände mit bestimmt wird, wie Sexualpraktiken, andere sexuell übertragbare Erkrankungen, Hautläsionen, Beschneidung und Schleimhautverletzung. Das durchschnittliche Transmissionsrisko für unterschiedliche Sexualpraktiken ist in der Tabelle 1 zusammengefasst.
Tabelle 1: Risikowahrscheinlichkeit für die HIV-Übertragung (modifiziert nach den Leitlinien der Deutschen und Österreichischen AIDS-Gesellschaft siehe auch www.daignet.de) |
|
| Art des Kontaktes/Partners |
Infektionswahrscheinlichkeit je Kontakt |
| Ungeschützter rezeptiver Analverkehrmit bekannt HIV-positivem Partner |
0,82 % (95 % KI 0,24 – 2,76) Range 0,1 – 7,5 %* |
| Ungeschützter rezeptiver Analverkehr mit Partner von unbekanntem HIV-Serostatus |
0,27 % (95 % KI 0,06 – 0,49) |
| Ungeschützter insertiver Analverkehr mit Partner von unbekanntem HIV-Serostatus |
0,06 % (95 % KI 0,02 – 0,19) |
| Ungeschützter rezeptiver Vaginalverkehr |
0,05 – 0,15 % |
| Ungeschützter insertiver Vaginalverkehr |
0,03 – 5,6 % |
| Oraler Sex |
keine Wahrscheinlichkeit bekannt, jedoch sind Einzelfälle, insbesondere bei Aufnahme von Sperma in den Mund, beschrieben (Lifson 1990) |
Anmerkung: 95 % KI = Konfidenzintervall nach einer großen HIV-Serokonverterstudie (Vittinghoff 1999). *Schätzungen der Infektionswahrscheinlichkeit im Rahmen weiterer Studien – siehe auch Leitlinien zur HIV-Therapie, DMW 2009, 134:S16-S33
Die Abhängigkeit des Transmissionsrisikos von der vorliegenden Virusmenge hat wichtige epidemiologische Konsequenzen. Dort, wo Körperflüssigkeiten wie Blut und Sperma innerhalb von Tagen und Wochen mit vielen Personen ausgetauscht werden, besteht ein deutlich erhöhtes Risiko, Menschen zu begegnen, die erst seit kurzer Zeit infiziert und daher hoch infektiös sind. Ebenso erhöht ist die Wahrscheinlichkeit, innerhalb der wenigen Wochen zwischen der eigenen Neuinfektion und dem Auftreten von Antikörpern andere Menschen zu infizieren. Besonders infektiös ist dann wieder das Stadium, wenn ohne Kenntnis der Diagnose die Infektion fortschreitet und kurz vor Ausbruch von AIDS erneut hohe Viruslasten zu beobachten sind. Geschlechtskrankheiten und Entzündungen öffnen physiologische Haut- und Schleimhautbarrieren und steigern so das Risiko einer HIV-Infektion. Dies gilt insbesondere in den Endemiegebieten mit hoher Prävalenz anderer Geschlechtskrankheiten. So sind vor allem genitale Herpesinfektionen ein möglicher Kofaktor für die Verbreitung von HIV in Endemiegebieten (Mahiane 2009).
Die Beobachtung, dass die Höhe der Viruslast offensichtlich entscheidend für die Infektiosität einer infizierten Person ist, hat eine zum Teil sehr kontroverse Diskussion über die Möglichkeit ungeschützter Sexualkontakte ausgelöst. So hat die Eidgenössische Kommission für AIDS-Fragen (EKAF) vorgeschlagen, HIV-infizierte Personen, deren Viruslast unter ART unter Nachweisgrenze ist und die seit mindestens sechs Monaten antiretroviral behandelt werden, die Behandlung konsequent und zuverlässig durchführen und sich regelmäßig in ärztliche Kontrolle begeben sowie keine Infektionen mit anderen sexuell übertragbaren Erregern aufweisen, als Personen zu betrachten, die HIV über Sexualkontakte vermutlich nicht weitergeben und entsprechend auch ungeschützt Sex haben dürfen (Vernazza 2008).
Ziel der EKAF-Empfehlung ist es, Menschen mit und ohne HIV-Infektion Ängste zu nehmen und dadurch ein weitgehend normales Sexualleben zu ermöglichen. Diese Meinung wird jedoch nicht von allen im HIV-Bereich Tätigen geteilt. Jüngst sorgte ein Fall aus Frankfurt für Aufsehen (Stürmer 2008), bei dem HIV trotz nicht nachweisbarer Viruslast unter ART übertragen worden war (siehe auch ART-Kapitel Prävention).
Spritzentausch
Die gemeinsame Nutzung von Spritzen und Kanülen ist der wichtigste Übertragungsweg für HIV bei Menschen, die intravenös drogenabhängig sind. Aufgrund der meist recht großen Blutmenge, die übertragen wird, ist das Risiko hoch. Durch die Aspiration zur Überprüfung der Nadellage wird Blut in die Spritze eingebracht und stellt so das Reservoir für eine Übertragung dar.
Mit Einführung der Nadelaustauschprogramme, Aufstellen von Spritzenautomaten, Methadon-Substitution und durch viele andere präventive Maßnahmen sowie soziale Programme hat sich die HIV-Transmissionsrate bei intravenös Drogenabhängigen in Westeuropa erfreulicherweise dramatisch reduziert. In osteuropäischen Ländern, wo Drogengebrauch als kriminelle Tat verfolgt wird und keine sauberen Spritzbestecke zur Verfügung gestellt werden, findet sich ungebrochen eine weitere Zunahme der HIV-Transmissionen. Es bleibt zu hoffen, dass die Erfolge in Westeuropa zu einer liberalen Handhabung und Bereitstellung solcher Präventionsprogramme in Osteuropa führen werden.
Mutter-Kind-Übertragung
Ohne jede Maßnahme werden bis zu 40 % der Kinder HIV-1-positiver Mütter mit HIV-1 infiziert. Der wichtigste Risikofaktor ist die Viruslast zum Zeitpunkt der Geburt. Seit 1995 konnte in Deutschland bei Schwangeren mit bekannter HIV-1-Infektion die Mutter-Kind-Transmissionsrate auf 1 bis 2 % reduziert werden. Diese niedrige Übertragungsrate wurde erreicht durch die Kombination einer antiretroviralen Behandlung bzw. Prophylaxe der Schwangeren, einer elektiven Sectio vor Beginn der Wehen, der antiretroviralen Postexpositionsprophylaxe des Neugeborenen und Stillverzicht.
Zu Details siehe das Kapitel HIV und Schwangerschaft sowie die Deutsch-Österreichischen Empfehlungen zur HIV-Therapie in der Schwangerschaft bei HIV-exponierten Neugeborenen (DMW 2009; 134: S 40-S 54).
Blut
Die Übertragung von HIV über Blut und Blutprodukte bleibt weltweit ein zwar immer geringer werdendes, aber dennoch nicht vollständig eliminiertes Infektionsrisiko. In Deutschland gelten Blut und Blutprodukte als sicher. Seit 1985 werden alle Blutspenden auf Antikörper gegen HIV-1 getestet, seit 1989 auch auf HIV-2. Seit einigen Jahren werden jetzt auch Sammel-PCR durchgeführt, um auch Spender zu identifizieren, die in der Serokonversion sind und bei denen der HIV-ELISA noch nicht positiv ist. Weiterhin werden Menschen mit so genanntem Risikoverhalten, also aktiv drogenabhängige oder promiskuitive Männer und Frauen, sowie Einwanderer aus Hochendemiegebieten von einer Blutspende ausgeschlossen.
Beruflich erworbene HIV-Infektion
Das Risiko, sich nach einer Nadelstichverletzung mit HIV-infiziertem Material zu infizieren, liegt insgesamt bei 0,3 %. Dabei ist das Risiko bei einer Hohlnadel – z.B. bei der Blutentnahme – deutlich höher als bei einer chirurgischen Nadel. Zur Postexpositionsprophylaxe siehe das entsprechende Kapitel in diesem Buch. Die Gefahr, die von HIV-infiziertem Medizinpersonal selber ausgeht, ist hingegen als sehr gering einzustufen. 1993 wurden 19.036 Patienten von 57 HIV-infizierten Ärzten, Zahnärzten und Medizinstudenten untersucht (CDC 1993a). Zwar waren 92 Patienten HIV-positiv, doch war keiner von seinem Behandler infiziert worden.
Nicht taugliche Übertragungswege
Im Allgemeinen ist HIV durch Alltagskontakte zwischen Familienangehörigen unwahrscheinlich. Wichtig ist es, Blut-Blut-Kontakte zu vermeiden. Daher sollten keine Rasierklingen oder Zahnbürsten gemeinsam benutzt werden. Im Falle von Kanülenbenutzung sollten die Kanülen direkt in den Abwurfbehälter gelangen und nicht in die Plastikspritze zurückgesteckt werden.
Insekten
Alle Studien, die eine mögliche Übertragung von HIV durch Insekten untersucht haben, sind zu dem gleichen Ergebnis gekommen, nämlich dass dies nicht möglich ist. Dies gilt auch für Studien, die in Afrika mit hoher AIDS-Prävalenz und großen Insektenpopulationen, wie z.B. Mücken, durchgeführt worden sind (Castro 1988).
Der natürliche Verlauf der HIV-Infektion
Der natürliche Verlauf – also ohne antiretrovirale Therapie – ist in der Abbildung 1 dargestellt. Kurze Zeit nach der Erstinfektion wird bei einigen Patienten ein so genanntes akutes retrovirales Syndrom beobachtet, das selten länger als vier Wochen andauert. Leitsymptome sind Lymphknotenschwellung, Fieber, ein makulopapulöses Exanthem und Myalgien (siehe auch das Kapitel Akute HIV-Infektion). Die Symptome sind dabei unspezifisch und variabel, so dass die HIV-Diagnose kaum ohne einen konkreten Verdacht gestellt wird. Eine Periode von mehreren Jahren folgt, in denen die meisten Patienten klinisch asymptomatisch sind.
Danach können Beschwerden oder Erkrankungen auftreten, die nach der CDC-Klassifikation (siehe Tabelle 2) der klinischen Kategorie B zugeordnet werden. Hier sind insbesondere oraler Soor, die orale Haarleukoplakie und der Herpes Zoster zu erwähnen, welche differentialdiagnostisch immer an eine HIV-Infektion denken lassen sollten. Diese Erkrankungen sind zwar nicht AIDS-definierend, jedoch ursächlich auf die HIV-Infektion zurückzuführen und weisen auf eine Störung der zellulären Immunabwehr hin.
Noch später treten AIDS-definierende Erkrankungen auf – im Median 8 bis 10 Jahre nach der Erstinfektion. Sie führen ohne hochaktive antiretrovirale Therapie nach individuell unterschiedlich langer Zeit schließlich zum Tod.
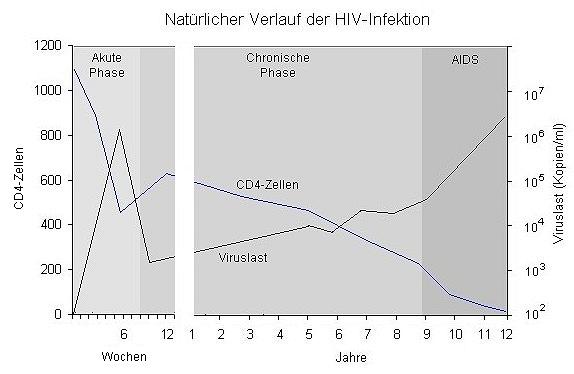 Abbildung 1: Der natürliche Verlauf der HIV-Infektion
Abbildung 1: Der natürliche Verlauf der HIV-Infektion
Die HI-Viruslast, die kurz nach der Primärinfektion extrem hohe Werte erreicht, sinkt zeitgleich mit dem Auftreten von HIV-Antikörpern meist auf weniger als 1 % des initialen Wertes ab und bleibt dann zunächst relativ stabil. Dieser Wert wird als viraler Setpoint bezeichnet. Seine Höhe bestimmt entscheidend die Geschwindigkeit der Krankheitsprogression. Während Patienten mit weniger als 1.000 HIV-RNA-Kopien/ml auch nach 12 Jahren so gut wie gar nicht an AIDS erkrankt sind, haben mehr als 80 % der Patienten, die zwei Jahre nach Serokonversion eine Viruslast von mehr als 100.000 Viruskopien aufweisen, bereits eine manifeste AIDS-Erkrankung entwickelt (O’Brien 1996).
Je höher der virale Setpoint ist, desto schneller kommt es zu einem Abfall der CD4-Zellen. Diese sinken meist schon deutlich während der akuten Infektion, um sich dann nach einigen Monaten zunächst wieder oberhalb der Normwerte, allerdings selten wieder auf die Werte vor Infektion, zu bewegen. Die Normwerte sind je nach Labor unterschiedlich und liegen für Erwachsene meist etwa „absolut“ bei 435 – 1600/µl bzw. „relativ“ bei 31 – 60 % der Lymphozyten. Für Kinder gelten andere Normwerte (siehe Kapitel Pädiatrie).
Im weiteren Verlauf kommt es dann zu einem allmählichen Abfall der CD4-Zellen. Ab einer CD4-Zellzahl von unter 200/µl muss dann mit zunehmender Zeit vermehrt mit dem Auftreten AIDS-definierender Erkrankungen gerechnet werden. Zu Abschätzung des Grades der Immundefizienz sollte dabei sollte immer auch der relative Anteil der CD4-Zellen mit berücksichtig werden, da unter bestimmten Umständen (z.B. unter myelosuppressiver Interferontherapie) niedrige absolute Helferzellen im Rahmen der Leuko- und Lymphopenie beobachtet werden, obwohl prozentual noch ein guter Immunstatus vorliegt. 200 CD4-Zellen/µl entsprechen dabei etwa 15 % CD4-positiver Lymphozyten. Umgekehrt kann die absolute Zahl auch falsch hohe Werte suggerieren, zum Beispiel nach Splenektomie.
| Tabelle 2: Klinische Kategorien der CDC-Klassifikation | |
| Kategorie AAsymptomatische HIV‑Infektion | |
- Akute, symptomatische (primäre) HIV-Infektion
- Persistierende generalisierte Lymphadenopathie (LAS)
Kategorie B
Krankheitssymptome oder Erkrankungen, die nicht in die Kategorie C fallen, dennoch aber der HIV‑Infektion ursächlich zuzuordnen sind oder auf eine Störung der zellulären Immunabwehr hinweisen. Hierzu zählen:
- Bazilläre Angiomatose
- Entzündungen des kleinen Beckens, besonders bei Komplikationen eines Tuben‑ oder Ovarialabszesses
- Herpes zoster bei Befall mehrerer Dermatome oder nach Rezidiven in einem Dermatom
- Idiopathische thrombozytopene Purpura
- Konstitutionelle Symptome wie Fieber über 38,5 Grad oder eine > 1 Monat bestehende Diarrhoe
- Listeriose
- Orale Haarleukoplakie (OHL)
- Oropharyngeale Candidose
- Vulvovaginale Candidose, die entweder chronisch (> 1 Monat) oder nur schlecht therapierbar ist
- Zervikale Dysplasien oder Carcinoma in situ
- Periphere Neuropathie
Kategorie CAIDS‑definierende Erkrankungen
- Candidose von Bronchien, Trachea oder Lungen
- Candidose, ösophageal
- CMV-Infektionen (außer Leber, Milz, Lymphknoten)
- CMV-Retinitis (mit Visusverlust)
- Enzephalopathie, HIV-bedingt
- Herpes simplex-Infektionen: chronische Ulzera (> 1 Monat bestehend; oder Bronchitis, Pneumonie, Ösophagitis
- Histoplasmose, disseminiert oder extrapulmonal
- Isosporiasis, chronisch, intestinal, > 1 Monat bestehend
- Kaposi-Sarkom
- Kokzidioidomykose, disseminiert oder extrapulmonal
- Kryptokokkose, extrapulmonal
- Kryptosporidiose, chronisch, intestinal, > 1 Monat bestehend
- Lymphom, Burkitt
- Lymphom, immunoblastisches
- Lymphom, primär zerebral
- Mycobacterium avium complex oder M. kansasii, disseminiert oder extrapulmonal
- Mycobacterium, andere oder nicht identifizierte Spezies disseminiert oder extrapulmonal
- Pneumocystis-Pneumonie
- Pneumonien, bakteriell rezidivierend (> 2 innerhalb eines Jahres)
- Progressive multifokale Leukoenzephalopathie
- Salmonellen-Septikämie, rezidivierend
- Tuberkulose
- Toxoplasmose, zerebral
- Wasting-Syndrom
- Zervixkarzinom, invasiv
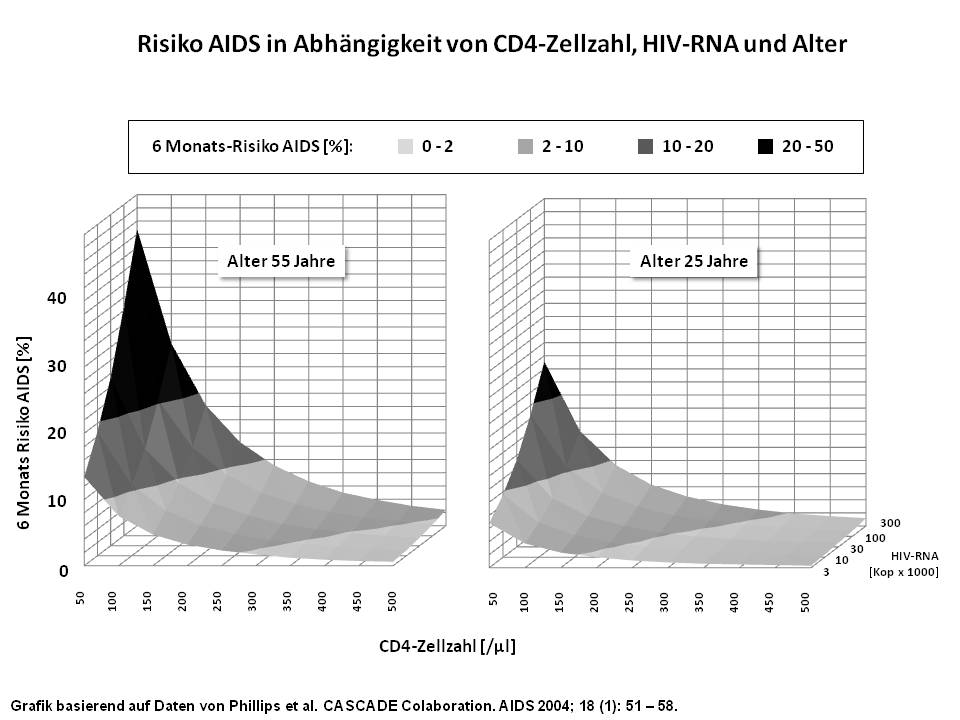
Je nach Geschwindigkeit des CD4-Zell-Abfalls unterscheidet man (nach Stein 1997) Patienten mit einem hohem Risiko der Krankheitsprogression (Abfall über 100/µl innerhalb von 6 Monaten), Patienten mit moderatem Risiko (Abfall 20-50/µl pro Jahr) und niedrigem Risiko (Abfall unter 20/µl pro Jahr). Während das AIDS-Risiko insgesamt unterhalb 200 CD4-Zellen/µl deutlich ansteigt, bestehen erhebliche Unterschiede zwischen den einzelnen AIDS-definierenden Erkrankungen (siehe auch Kapitel AIDS). So treten opportunistische Infektionen häufig bei deutlich niedrigeren CD4-Zellzahlen auf als AIDS-assoziierte Malignome (Schwartländer 1992). Neben der CD4-Zellzahl und der Höhe der Viruslast ist aber auch das Alter des Patienten ein wichtiger Risikofaktor an AIDS zu erkranken (Abbildung 2). So hat ein 55-jähriger Patient bei 50 CD4-Zellen/µl und einer HIV-RNA von 300.000 Kopien/ml ein fast doppelt so hohes AIDS-Risiko wie ein 25-jähriger Patient. In den aktualisierten HIV-Therapieleitlinien wird der empfohlene Therapiebeginn daher auch durch individuelle Faktoren wie Alter und Höhe der Viruslast mit bestimmt.
Zwischen der ersten AIDS-Komplikation und dem Tod vergingen in der „prä-HAART-Ära“ in der Regel zwischen zwei und vier Jahre. Ohne Therapie der Erkrankung sterben vermutlich mehr als 90 % aller HIV-Patienten an AIDS. Mit der Verfügbarkeit der ART lässt sich heute jedoch ein Voranschreiten der Erkrankung bis hin zum Stadium AIDS verhindern. Mit Erreichen der maximalen Suppression der HIV-RNA kommt es in aller Regel auch zu einer Erholung der CD4-Zellzahlen und zu einer fast normalen Lebenserwartung. Die Höhe der Viruslast bzw. des viralen Setpoints wird bestimmt durch eine Reihe von wirtsspezifischen Faktoren, wie Chemokinrezeptormutationen, HLA-Besatz und weiteren, zum Teil noch nicht identifizierten Faktoren. Hinzu kommen auch viruseigene Faktoren, die mit für die Progression entscheidend sein dürften. Hierzu sei auf das Kapitel Grundlagen verwiesen. Wichtig ist es, sich vorzustellen, dass es sich bei der messbaren Virusaktivität um ein Gleichgewicht zwischen entstehenden und abgetöteten Viren handelt.
Stadieneinteilung der HIV-Infektion
Zur Stadien-Einteilung wird meist noch die CDC-Klassifikation von 1993 benutzt, die als Kriterien sowohl die CD4-Zellzahl als auch die Klinik des individuellen Patienten verwendet (siehe Tabelle 3). Für beide Kriterien gibt es jeweils drei Stadien.
| Tabelle 3: Einteilung der HIV-Erkrankung nach der CDC-Klassifikation von 1993 | |||
| Klinik /CD4-Zellen |
asymptomatisch oder akute HIV-Krankheit |
Symptomatisch aber nicht A oder C |
AIDS-Erkrankung* |
| > 500/µl |
A1 |
B1 |
C1 |
| 200 – 499/µl |
A2 |
B2 |
C2 |
| < 200/µl |
A3 |
B3 |
C3 |
*zu den AIDS-Erkrankungen bzw. Klinik siehe Tabelle 2.
In 2008 wurde eine überarbeitete Version des CDC zur Stadien-Einteilung von HIV/AIDS vorgelegt. Diese gilt für Jugendliche über 13 Jahre und Erwachsene gleichermaßen und ist in der Tabelle 4 zusammengefasst. Ziel der Überarbeitung war es, eine vereinfachte Einteilung zum epidemiologischen Monitoring von HIV und AIDS anzubieten, die zudem der verbesserten Diagnostik und Behandlungsmöglichkeiten Rechnung tragen sollte. Neben den unten neu eingeführten drei Stadien der HIV-Infektion wurde auch eine vierte Kategorie (HIV-Infektion, Stadium unbekannt) eingeführt in den Patienten ohne Kenntnis von CD4-Zellzahl oder Krankheitsvorgeschichte aufgeführt werden können.
Tabelle 4: Einteilung der HIV-Erkrankung nach der CDC-Klassifikation von 2008 |
||
| Stadium |
AIDS-Erkrankungen* |
CD4-Zellen |
| 1 |
keine |
> 500/µl oder ≥ 29 % |
| 2 |
keine |
200 – 499/µl oder 14-28 % |
| 3 |
Dokumentierte AIDS -Erkrankung |
oder < 200/µl oder <14 % |
| unbekannt |
Keine Information vorhanden |
Keine Information vorhanden |
*zu den AIDS-Erkrankungen siehe Tabelle 2, hier hat es keine Änderungen gegeben.
Grundsätzlich gilt, dass ein Patient bei Progression der Erkrankung neu klassifiziert wird, aber keine Rückstufung möglich ist. Ein Beispiel: So erhält ein zuvor asymptomatischer Patient mit 530 CD4-Zellen/µl (Kategorie A1, neue Klassifikation: Stadium 1) bei einem oralen Soor und einem Abfall der CD4-Zellen auf 320/µl die Kategorie B2 (neu: Stadium 2). Wenn derselbe Patient nach erfolgreicher Soor-Therapie und Einleitung der ART erneut eine CD4-Zellzahl von 550/µl aufweist, so bleibt die Kategorie B2 (neu: Stadium 2) bestehen.
Die CDC-Klassifikation ermöglicht eine rasche erste Orientierung zum (bislang schlechtesten) Zustand eines HIV-Patienten. Über die aktuelle Situation sagt sie allerdings nichts aus. Anders als in Europa, wo der Begriff AIDS nur angewendet wird, wenn eine AIDS-definierende Erkrankung aufgetreten ist, wird in den USA auch ein Abfall der CD4-Zellen auf unter 200/µl als AIDS gewertet. Alte Staging-Systeme wie Walter-Reed oder die Frankfurter Klassifikation werden nicht mehr verwendet.
Epidemiologie
Das HI-Virus ist wahrscheinlich in den 20–30er Jahren des vergangenen Jahrhunderts entstanden, als in Westafrika das Simian Immunodeficiency Virus (SIV) vom Schimpansen auf den Menschen übertrat (Worobey 2008). Die älteste HIV-positive Probe eines Menschen stammt aus dem Jahr 1959 und wurde in Kinshasa (Zaire, Demokratische Republik Kongo) gefunden (Zhu 1998). Nach der Erstbeschreibung von AIDS 1981 gibt es inzwischen kein Land mehr, das nicht betroffen ist.
Meist erkranken zunächst Personen aus so genannten Hochrisikogruppen (i.v. Drogengebraucher/-innen, Menschen in der Prostitution und Männer, die Sex mit Männern haben), wobei sich anschließend auch andere Personengruppen durch ungeschützten Sex anstecken. In den meisten Industrienationen ist homosexueller Geschlechtsverkehr der häufigste Übertragungsmodus, in den Ländern der ehemaligen Sowjetunion sind dies intravenöser Drogengebrauch und Austausch von Spritzen. In Subsahara/Afrika infizieren sich die meisten Menschen durch heterosexuellen Geschlechtsverkehr. Die Prävalenzen in verschiedenen Ländern und die Auswirkungen der Epidemie auf Gesellschaften unterscheiden sich somit deutlich. Während HIV/AIDS in den Industriestaaten Westeuropas ein eher marginales Gesundheitsproblem darstellt, ist AIDS in Subsahara/Afrika zur häufigsten Todesursache überhaupt geworden. Jeder 5. Todesfall in Afrika ist inzwischen auf HIV/AIDS zurückzuführen. Die Lebenserwartung ist in einigen afrikanischen Staaten um über 20 Jahre gesunken. Weit über 10 Millionen Kinder wurden bereits zu Waisen. Die Wirtschaft der hauptbetroffenen Staaten erlitt und erleidet massive Einbrüche. Laut UNAIDS lebten Ende 2008 weltweit 33,4 Millionen Menschen mit HIV/AIDS (davon 31,3 Millionen Erwachsene, 15,7 Millionen Frauen über 15 Jahre und 2,1 Millionen Kinder unter 15 Jahre). Etwa 2,0 Millionen Menschen starben an AIDS (siehe Tabelle 4).
Tabelle 5: Die AIDS-Epidemie nach Daten von UNAIDS, 2010 (www.unaids.org) |
||||
|
HIV-infizierte Erwachsene und Kinder |
HIV-Prävalenz unter Erwachsenen in 2009 |
Neuinfektionen in 2009 |
Jährliche Todesfälle durch AIDS in 2009 |
|
| Subsahara-Afrika |
22.500.000 |
5,0 % |
1.800.000 |
1.300.000 |
| Naher Osten und Nordafrika |
460.000 |
0,2 % |
75.000 |
24.000 |
| Süd- und Südostasien |
4.100.000 |
0,3 % |
270.000 |
260.000 |
| Ostasien |
770.000 |
0,1 % |
82.000 |
36.000 |
| Ozeanien |
57.000 |
0,3 % |
4.500 |
1400 |
| Lateinamerika |
1.400.000 |
0,5 % |
92.000 |
58.000 |
| Karibik |
240.000 |
1,0 % |
17.000 |
12.000 |
| Nordamerika |
1.500.000 |
0,5 % |
70.000 |
26.000 |
| Osteuropa und Zentralasien |
1.400.000 |
0,8 % |
130.000 |
76.000 |
| West- und Zentraleuropa |
820.000 |
0,2 % |
31.000 |
8.500 |
| Gesamt |
33.300.000 |
0,8 % |
2.600.000 |
1.800.000 |
Am schwersten betroffen sind die Regionen Subsahara/Afrika, wo ca. 22 Millionen HIV-infizierter Menschen leben. Die größte Ausbreitungsgeschwindigkeit zeigt sich derzeit in den Ländern der ehemaligen Sowjetunion, vor allem in Estland, Lettland, Russland und der Ukraine sowie in Süd- und Südostasien.
In Deutschland lebten Ende 2010 laut Robert-Koch-Institut 63.500 Menschen mit HIV/AIDS, darunter 11.700 Frauen, siehe dazu die folgende Tabelle 5.
Tabelle 6: Epidemiologische Eckdaten zu HIV/AIDS in Deutschland (modifiziert nach rki.de) |
|
| Population | Infektionen (unterer – oberer Schätzwert) |
| Menschen, die Ende 2010 mit HIV/AIDS leben | ca. 70.000 (60.000 – 83.000) |
| Männer | ca. 57.000 (49.000 – 68.000) |
| Frauen | ca. 13.000 (11.000 – 16.000) |
| Darunter Kinder | ca. 200 |
| Verteilung nach Infektionsrisiko | |
| Männer, die Sex mit Männern haben | ca. 42.000 (36.000 – 49.000) |
| Personen, die sich über heterosexuelle Kontakte infiziert haben | ca. 10.000 (8.700 – 12.000) |
| Personen aus sog. Hochprävalenzregionen | ca. 7.300 (6.900 – 9.200) |
| i.v. Drogengebraucher | ca. 10.000 (8.500 – 12.000) |
| Hämophile und Bluttransfusionsempfänger | ca. 500 |
| Mutter-Kind-Transmission | ca. 430 |
Zusammenfassung
Erste serologische Hinweise auf HIV-Antikörper finden sich in alten Seren aus Zaire von 1959, aus Uganda von 1972 und aus Malawi von 1974 – Beweise, dass HIV bereits um diese Zeit in Zentralafrika zirkulierte. Die ersten AIDS-Fälle sind dann 1981 in den USA beschrieben worden. 1983 folgte die Entdeckung von HIV als Ursache von AIDS. Seitdem ist es zu einer weltweiten Epidemie gekommen, die sich auch jetzt, 30 Jahre später, mit 2,6 Millionen Neuinfektionen pro Jahr ungebrochen weiter verbreitet. Insbesondere die hohen Neuinfektionsraten in Osteuropa und Asien deuten auf die vielfachen Herausforderungen im Bereich der Prävention hin, die es aktuell und in der nahen Zukunft zu meistern gilt. Wenngleich die Erfolge der antiretroviralen Behandlung der HIV-Infektion an eine fast normale Lebenserwartung von HIV-infizierten Menschen glauben lassen, so bleibt doch das Wissen um den natürlichen Verlauf der HIV-Infektion substantiell – und zwar nicht nur, um den richtigen Zeitpunkt für den Beginn einer ART zu bestimmen, sondern um auch bei Menschen mit ersten Symptomen der HIV-Erkrankung die Diagnose vor Ausbruch von AIDS zu stellen. Angesichts von einem Anteil von 50 % aller infizierten Menschen in Europa, die von ihrer HIV-Infektion noch nichts wissen, bleiben auch in der Diagnosestellung erhebliche Herausforderungen. Diese werden in Europa momentan gemeinsam angegangen (www.HIVeurope.eu) werden, nicht nur um Patienten rechtzeitig antiretroviral behandeln zu können, sondern auch um durch entsprechende Behandlung und Aufklärung die Neuinfektionszahlen zu reduzieren.
Literatur
Anonymous: Acquired immunodeficiency in hemophilia. Lancet 1983; 1: 745
Barre-Sinoussi F, Chermann JC, Rey F, et al. Isolation of a T-lymphotropic retrovirus from a patient at risk for AIDS. Science 1983, 220: 868-71.
Bartholomew CF, Jones AM. Human bites: a rare risk factor for HIV transmission. AIDS 2006, 20:631-2.
Castro KG, Lieb S, Jaffe HW, et al. Transmission of HIV in Belle Glade, Florida: lessons for other communities in the US. Science 1988, 239: 193-7.
Centers for Disease Control (1982a). Epidemiologic notes and reports persistent, generalized lymphadenopathy among homosexual males. MMWR Morb Mortal Wkly Rep 1982, 31: 249
Centers for Disease Control (1982b). Epidemiologic notes and reports update on kaposi’s sarcoma and opportunistic infections in previously healthy persons — United States. MMWR Morb Mortal Wkly Rep 1982, 31: 294.
Centers for Disease Control (1993a). Investigations of persons treated by HIV-infected health-care workers – United States. MMWR Morb Mortal Wkly Rep 1993, 42: 329-31.
Centers for Disease Control (2008). Revised surveillance case dfintions for HIV infection among adults, adolescents, and children aged <18 months and for HIV infection and AIDS among children aged 18 months to <13 years — United States, 2008. MMWR Recommendations and Reports 2008;57:1-8
Essex M, Adult T-cell leucemia/lymphoma: role of a human retrovirus. J Natl Cancer Inst 1982; 69: 981-985
Essex M, McLane MF, Lee TH, et al. Antibodies to cell membrane antigens associated with human T-cell leucemia virus in patients with AIDS. Science 1983; 22: 859-862
Essex ME. Origin of acquired immunodeficiency syndrome. In: VT DeVita jun, S Hellman, SA Rosenberg: AIDS: Biology, diagnosis, treatment and prevention. 4th edition, Lippincott-Raven Publ, 3-14; 1997
Eyster ME, Koch KL, Abt AB, et al. Cryptosporidiosis in a hemophiliac with acquired immunodeficiency. Blood 1982; 60 (Suppl 1): 211A (abstract)
Gallo RC, Sarin PS, Gelmann EP, et al. Isolation of human T-cell leucemia virus in acquired immunodefiency syndrome. Science 1983; 220: 865-867
Gaur A, Dominguez K, Kalish M, Rivera-Hernandez D, Donohoe M, Mitchell C. Practice of offering a child pre-masticated food: an unrecognized possible risk factor for HIV transmission. Abstract 613b, 15th CROI 2008, Boston.
Goldsmith JC, Moseley PL, Monick M, et al. T-lymphocyte subpopulation abnormalities in apparently healthy patients with hemophilia. Ann Intern Med 1983; 98: 294-296
Gottlieb MS (1981a), Schanker HM, Fan PT, et al. Pneumocystis Pneumonia – Los Angeles. MMWR Weekly 1981, 30: 250-2s.
Gottlieb MS (1981b), Schroff R, Schanker HM, et al. Pneumocystis carinii pneumonia and mucosal candidiasis in previously healthy homosexual men: evidence of a new acquired cellular immunodeficiency. N Engl J Med 1981, 305:1425-31.
Henderson DK, Fahey BJ, Willy M, et al. Risk for occupational transmission of human immunodeficiency virus type 1 (HIV-1) associated with clinical exposures. A prospective evaluation. Ann Intern Med 1990, 113:740-6.
Kornfeld H, Vande-Stouwe RA, Lange M, et al. T-lymphcyte subpopulations in homosexual men. New Engl J Med 1982; 307: 729-731
Lifson AR, O’Malley PM, Hessol NA, et al. HIV seroconversion in two homosexual men after receptive oral intercourse with ejaculation: implications for counseling concerning safe sexual practices. Am J Public Health 1990; 80: 1509-1511
Luban NLC, Kelleher JF jr, Reaman GH. Altered distribution of T-lymphocyte subpopulations in children and adolescents with haemophilia. Lancet 1983; 1: 503-505
Mahiane SG, Legeai C, Taljaard D, et al. Transmission probabilities of HIV and herpes simplex virus type 2, effect of male circumcision and interaction: a longitudinal study in a township of South Africa. AIDS 2009; 23: 377-383
Marx JL. New disease battles a medical community. Science 1982; 217: 618-621
Masur H, Michelis MA, Greene JB, et al. An outbreak of community-acquired Pneumocystis carinii pneumonia: initial manifestation of cellular immune dysfunction. N Engl J Med 1981, 305:1431-8.
Mildvan D, Mathur U, Enlow RW, et al. Opportunistic infections and immune deficiency in homosexual men. Ann Intern Med 1982; 96: 700-704
O’Brien TR, Blattner, WA, Waters D, et al. Serum HIV-1 RNA-levels and time to development of AIDS in the Multicenter Hemophilia Cohort Study. JAMA 1996; 276: 105-110
Poiesz PJ, Ruscetti FW, Gazdar AF, et al. Detection and isolation of type C retrovirus particles from fresh and culture lymphocytes of a patients with cutanous T-cell lymphoma. Proc Natl Acad Sci USA 1980; 77: 7415-7419
Popovic M, Sarngadharan MG, Read E, et al. Detection, isolation and continuous production of cytopathic retroviruses (HTLV-III) from patients with AIDS and pre-AIDS. Science 1984; 224: 497-500
Ragni MV, Lewis JH, Spero JA, et al. Acquired immunodeficiency-like syndrome in two haemophiliacs. Lancet 1983; 1: 213-214
Rasi VP, Koistinen JL, Lohman CM, et al. Normal T-cell subset ratios in patients with severe haemophilia A treated with cryoprecipitate. Lancet 1984; 1: 461.
Rockstroh JK, Ewig S, Bauer T, et al. Male to female transmission of HIV in a cohort of hemophiliacs-frequency, risk-factors and effect of sexual counseling infection 1995; 23: 29-32
Schwartländer B, Horsburgh CR Jr, Hamouda O, et al. Changes in the spectrum of AIDS-defining conditions and decrease in CD4+ lymphocyte counts at AIDS manifestation in Germany from 1986 to 1991. AIDS 1992, 6:413-20.
Siegal FP, Lopez C, Hammer GS, et al. Severe acquired immunodeficiency in male homosexuals manifested by chronic perianal ulcerated herpes simplex lesions. N Engl J Med 1981; 305: 1439-1444
Stahl RE, Friedman-Kien A, Dubin R, et al. Immunologic abnormalities in homosexual men. Relationship to Kaposi’s sarcoma. Am J Med 1982; 73: 171-178
Stein DS, Lyles RH, Graham NM, et al. Predicting clinical progression or death in subjects with early-stage HIV infection: a comparative analysis of quantification of HIV RNA, soluble tumor necrosis factor type II receptors, neopterin, and beta2-microglobulin. J Infect Dis 1997, 176:1161-7.
Stürmer M, Doerr HW, Berger A, Gute P. Is transmission of HIV-I in non-viraemic serodiscordant couples possible? AntivirTher 2008; 13:729-732
Vernazza P, Hirschel B, Bernasconi E, Flepp M. HIV-infizierte Menschen ohne andere STD sind unter wirksamer antiretroviraler Therapie sexuell nicht infektiös. Schweizerische Ärztezeitung 2008; 89:5, 165-169. www.aids.ch/d/hivpositiv/pdf/EKAF_d.pdf
Vittinghoff E, Douglas J, Judson F, et al. Per-contact risk of hiv transmission between male sexual partners. Am J Epidemiol 1999, 150:306-11.
Worobey M, Gemmel M, Teuwen DE, et al. Direct evidence of extensive diversity of HIV-1 in Kinshasa by 1960. Nature 2008, 455:661-4.